مقدمه
دیابت ملیتوس یک بیماری مزمن غدد درونریز است که با هیپرگلیسمی مداوم همراه است که اغلب ناشی از کمبود مطلق یا نسبی ترشح انسولین یا مقاومت به انسولین است [1]. نتایج مطالعات اخیر فدراسیون بینالمللی دیابت مشاهده کردند که در سراسر جهان 382 میلیون کودک و بزرگسالان در سال 2013 از دیابت رنج میبرند و پیشبینی شده است تعداد بیماران مبتلا به دیابت تا سال 2025 به بیش از 592 میلیون نفر در جهان میرسد [2]. شواهد زیادی حکایت از نقش استرس اکسیداتیو و به دنبال آن تولید رادیکالهای آزاد در پاتوژنز بیماری دیابت دارند [3]. از جمله اختلالات چشم، اعصاب، کلیه و نارساییهای کبدی از عوامل عمده مرگومیر در بیماران دیابتی شناخته شدهاند [4].
کبد، اندامی مؤثر در حفظ سطح گلوکز خون در محدوده طبیعی است و افزایش قند خون به تعادلنداشتن واکنشهای اکسیداسیون ـ احیای سلولهای کبدی منجر میشود [5]. افزایش در آنزیمهای کبدی آلانین آمینوترانسفراز و گاما گلوتامیل ترانسفراز، آسپارتات آمینوترانسفراز، آلکالین فسفاتاز به عنوان پیشبینیکننده دیابت مطرح شده است [6]. بیماری دیابت، سطح آنزیمهای کبدی را در خون افزایش میدهد که علت اصلی آن، افزایش استرس اکسیداتیو در نواحی بافتی است و میتواند تا حدی به علت افزایش قند خون باشد [6]. پژوهشها نشان دادهاند که غلظت پلاسمایی این آنزیمها، بهترین شاخص برای ارزیابی وضعیت کبد هستند، زیرا با آسیب سلولهای کبدی، میزان آنها در خون افزایش مییابد [7].
از طرفی پیکولینات کروم یک مکمل است که برای سوختوساز کربوهیدرات، پروتئین و چربی طبیعی مورد نیاز است و به دلیل بهبود وضعیت گلیسمی خون، درباره آن بحث میشود و تا به امروز، استفاده از آن به روش بالینی پیشنهاد نشده است. کروم یک ماده معدنی ضروری است که برای متابولیسم طبیعی گلوکز و لیپید ضروری است و از آنجا که تحمل گلوکز را افزایش میدهد و سطح قند خون را متعادل میکند، کمبود کروم ممکن است به برخی از اختلالات مثل کاهش تحمل گلوکز، افزایش سطح انسولین سرم و کاهش تعداد گیرندههای انسولین که از علائم دیابت نوع 2 است، منجر شود [9 ،8]. جین و همکاران نیز گزارش کردهاند که مکمل کروم میتواند از طریق افزایش ویتامین C و آدیپونکتین پلاسما و مهار NFkB، AKT، و GLUT2 در کبد موجب کاهش گلوکز، CRP، MCP-1، ICAM-1 و کراتینین در موشهای چاق دیابتی شود [10].
در پژوهشهای صورتگرفته در ایران، مشاهده شده است که غلظت کرومیوم در سرم بیمارن دیابتی و افرادی که اختلال تحمل گلوکز دارند، به طور معناداری از گروه کنترل کمتر است [11]. با این حال نتایج یافتههای مربوط به تجویز مکمل کروم در افراد سالم و بیماران مبتلا به دیابت متفاوت بوده است. یافتههای مطالعات پیشین نشان داده مصرف مکمل کروم در افراد دارای سندرم متابولیک میتواند سبب افزایش سوخت چربیهای بدن با بهبود سوختوساز گلوکز شود [12].
همچنین فعالیت بدنی میتواند پاسخ عضله اسکلتی به انسولین را از طریق افزایش بیان و یا فعالیتهای پروتئینهای درگیر در متابولیسم و سیگنالینگ انسولین افزایش دهد. به طوری که فعالیت بدنی فعالیت گلیکوژن سنتاز و بیان پروتئینهای ناقل گلوکز را افزایش میدهد. در افراد مبتلا به دیابت نیز آمادگی بدنی با کاهش اکسیداسیون چربی و جابهجایی به سمت اکسیداسیون بیشتر کربوهیدرات در تمام شدتهای ورزشی همراه است. در بیماران دیابتی که نقص در عملکرد انسولین دارند، تمرینات بدنی منظم موجب میشود از طریق افزایش حساسیت به انسولین و همچنین در غیاب انسولین، ورود قند به داخل سلولهای عضلانی و درنتیجه مصرف آن تسهیل شود. همچنین فعالیتهای ورزشی با افزایش سطوح پروتئینهای ناقل گلوکز باعث کاهش مقاومت به انسولین میشود [13].
اثرات مثبت تمرینات استقامتی در مطالعات علمی انکارناپذیر است، اکنون با توجه به نتایج تحقیقات جدید روشن شده است هنگامی که سلامت کلی فرد، «فواید عملکردی برای افراد» در نظر گرفته میشود، تمرین مقاومتی نسبت به استقامتی معمولاً نتایج مطلوبتری را در زمان کوتاهتری حاصل کرده است [14]. به طوری که در تحقیق کاوزا و همکاران بهوضوح مشخص شد که تمرین مقاومتی نسبت به استقامتی، موجب کاهش بیشتر قند خون ناشتا و میزان انسولین و افزایش بیشتر حساسیت به انسولین در افراد دارای دیابت نوع 2 شد [15].
افرادی که قصد شرکت در فعالیتهای ورزشی را دارند، نمیتوانند خستگی برای پرداختن به فعالیت مقاومتی را در این گونه تمرینات بهانه کنند، زیرا تمرین مقاومتی نسبت به تمرینات استقامتی دارای وهلههای استراحت بوده و زمان برگشت به حالت اولیه را در بین ستها و حرکات فراهم میکند [16]. همچنین به این دلیل که معمولاً بیماران دیابتی دارای اضافه وزن هستند و شیوه زندگی غیرفعالی دارند، انجام این تمرینات استقامتی برای همه این افراد امکانپذیر نیست. چنین افرادی انگیزه و توان کافی برای فعالیتهای بدنی استقامتی را ندارند. لازمه فعالیت بدنی در بیماران دیابتی مسن، داشتن مقدار معینی از قدرت و استقامت عضلانی است که میتواند از طریق تمرینات مقاومتی حاصل شود [17].
درمجموع، در مورد نتایج اثر مکمل پیکولینات کروم تناقض زیادی وجود دارد و از سویی سازوکار تأثیر مفید تمرینی مقاومتی همراه با مکمل پیگولینات کروم بر آنزیمهای کبدی بهخوبی روشن نیست. بنابراین این پژوهش با هدف بررسی اثر همزمان مصرف مکمل پیکولینات کروم و تمرین مقاومتی بر سطح سرمی آنزیمهای کبدی و شاخص مقاومت به انسولین مردان دیابت نوع 2 بود تا بتوان راهکار بهتری در پیشگیری و بهبود عوارض دیابت با کنترل شاخصهایی مرتبط ارائه دهیم.
مواد و روشها
تحقیق حاضر از نوع نیمهتجربی در قالب سه گروه با طرح پیشآزمونـپسآزمون است که از میان مردان میانسال مبتلا به دیابت نوع 2 که به مرکز درمانی شهر شیراز مراجعه کرده بودند، 34 نفر داوطلب شرکت در این تحقیق شدند که پس از ارزیابیهای اولیه و لحاظ معیارهای سن در محدوده 45 تا 60 سال، نداشتن سابقه بیماری قلبیعروقی، داشتن سابقه بیماری دیابت بیشتر از شش ماه، شرکت نداشتن در فعالیت بدنی منظم در شش ماه اخیر، نداشتن فشار خون بیشتر از 95/160 میلیمتر جیوه، استعمالنکردن دخانیات، مصرفنکردن مکمل، تغییرندادن مصرف داروهای کاهنده قند خون، کنترل فشار خون و چربی خون با نظارت متخصص غدد در دو ماهه اخیر، 34 آزمودنی واجد شرایط انتخاب شدند.
پس از توضیح مراحل مطالعه و اخذ رضایتنامه آگاهانه از آزمودنیها، آنها بهطور تصادفی در سه گروه کنترل دیابتی (10 نفر)، تمرین مقاومتی به همراه دارونما (12 نفر) و تمرین مقاومتی به همراه مکمل پیکولینات کروم (12 نفر) قرار گرفتند. دو نفر از آزمودنیها بهدلیل شرکتنکردن مرتب در گروه تمرین مقاومتی در گروه دارونما و دو نفر بهدلیل مصرفنکردن مرتب مکمل پیکولینات کروم در گروه تمرین مقاومتی به همراه مکمل، در مرحله پایانی خونگیری از تحقیق حذف شدند و در نهایت این تحقیق با 30 آزمودنی دیابتی اجرا شد.
حجم نمونه بر اساس مطالعات قبلی در این زمینه و سپس بر اساس برآورد نرمافزار G*power انجام پذیرفت. یک هفته پیش از شروع برنامه تمرینی همه آزمودنیها فرم رضایتنامه شرکت در تحقیق و پرسشنامه غذایی سهروزه شامل یک روز تعطیل را تکمیل کردند و سپس در صورت لزوم، کارشناس تغذیه توصیههای غذایی لازم را برای دوره هشت هفتهای پروتکل تمرینی ارائه کرد. سپس آزمودنیها ساعت هشت صبح پیش از صرف صبحانه در وضعیت ناشتا در محل آزمایشگاه حضور یافتند و اولین نمونه خونی از ورید بازویی اخذ شد.
دومین مرحله خونگیری نیز 48 ساعت پس از آخرین جلسه تمرینی در زمان یکسان از آزمودنیها اخذ شد. وزن آزمودنیها با ترازو دیجیتال بیورر مدل PS07 ساخت شرکت آلمان با دقت 1/0 کیلوگرم، قد آنها با قدسنج مدل یاگامی ساخت ژاپن و شاخص توده بدنی با تقسیم وزن به کیلوگرم بر مجذور قد به متر محاسبه شد. ضخامت چین پوستی آزمودنیها با کالیپر Seahan مدل B00653TZNY ساخت کره جنوبی و درصد چربی با اندازهگیری چین پوستی سه نقطه ران، تحت کتفی، فوق خاصره و محاسبه چگالی بدن و قراردادن آن در فرمول سیری پولاک و جکسون (1976) تعیین شد.

اندازه گیریهای بیوشیمیایی
در هر مرحله خونگیری حدود 5 میلیلیتر خون از ورید پیش آرنجی آزمودنیها گرفته شد. 2 میلیلیتر از آن در لولههای بدون ماده ضدانعقاد منتقل شد. نمونه خونی پایانی 48 ساعت پس از آخرین جلسه تمرینی از آزمودنیها گرفته شد. نمونهها بلافاصله به آزمایشگاه منتقل شد و در آزمایشگاه سرم خون توسط دستگاه سانتریفیوژ (به مدت پنج دقیقه با سه هزار دور در دقیقه) جدا شد و در میکروتیوبها جمعآوری و در دمای منفی 20 درجه سانتیگراد تا زمان انجام تحلیل فریز شد. شاخصهای خونی اندازهگیریشده شامل آنزیمهای کبدی با استفاده از کیتهای پارسآزمون و و با استفاده از دستگاه اتوآنالیزور 0001 RA Tecnicon ساخت شرکت Tecnicon آمریکا و براساس دستورالعمل استاندارد اندازهگیری شد. همچنین قند خون ناشتا با کیت تشخیص کمی گلوکز در سرم با روش فتومتریک، ساخت شرکت پارسآزمون ایران با حساسیت پنج میلیگرم در دسیلیتر، انسولین سرمی با روش الایزا و با استفاده از کیت شرکت Mono bind آمریکا با درجه حساسیت 15/0 میکروگرم بر میلیلیتر، مقاومت انسولین با استفاده از فرمول شماره ۱ به دست آمد.
۱.
HOMA-IR = انسولین ناشتا (µU/mL) x گلوکز ناشتا (mmol/l) ÷ 22/5
برنامه تمرینات مقاومتی
در ابتدا از شرکت کنندگان در هفته اول پس از آشنایی با انجام تمرینات مقاومتی آزمون یک تکرار بیشینه برای تعیین قدرت عضلانی آزمودنیها گرفته شد و سپس قبل از شروع هفته پنجم نیز آزمون یک تکرار بیشینه مجدد برای تعیین قدرت عضلانی گرفته شد. برنامـه مقـاومتی متشکل شش حرکت سرشانه دستگاه، پرس سینه دستگاه ، زیربغل از جلو با دستگاه سیم کش، پرس پا دستگاه، جلوپا دستگاه و پشت پا ایستاده دستگاه بود که شرکت کنندگان ابتدا حرکتهای بالاتنه و سپس حرکتهای پایین تنه را انجام میدادند. در پایان تمرین شرکت کنندگان با انجام حرکات کششی سبک فاز سردکردن را انجام میدادند. به منظور رعایت اصل اضافه بار تمرین، شدت تمرین از هفته اول تا چهارم با 40 تا 50 درصد یک تکرار بیشینه، دو تا سه ست با 20-15 تکرار و از هفته شش تا هشتم با 75 تا 85 درصد یک تکراربیشینه، دو تا سه ست با 8 تا 10 تکرار انجام شد [18]. مراحل اجرای پروتکل تمرین مقاومتی با جزئیات در جدول شماره 1 توضیح داده شده است.
پروتکل مصرف مکمل و دارونما
مکمل پیکولینات کروم از تنها نوع موجود در بازار مربوط به شرکت قرن بیستویکم آمریکا تهیه شد. با توجه به تعیین دُز مصرفی 400 میکروگرم در روز، آزمودنیهای گروه تمرین و مکمل به مدت هشت هفته و هر روز دو عدد از مکمل را پس از صبحانه و پس از شام مصرف کردند. همچنین دارونما از خط تولید دارو دانشکده داروسازی دانشگاه علوم پزشکی شیراز تهیه شد.در محتویات دارونما از یک ماده بیاثر (نشاسته) استفاده شد و تلاش شد دارونما نزدیکترین شکل و اندازه را نسبت به مکمل اصلی استفادهشده داشته باشد.
تجزیه وتحلیل آماری
نتایج به صورت میانگین و انحراف استاندارد برای نمونههای موجود در هر گروه بیان شد. جهت آنالیز آماری پس از اطمینان از نرمالبودن دادهها با استفاده از آزمون برآورد نرمالی شاپیروـ ویلیک و برای بررسی فرض برابری واریانسها از آزمون لون استفاده شد. پس از مشخصشدن طبیعیبودن توزیع دادهها و برقراری فرض برابری واریانسها، به منظور تجزیه و تحلیل آماری دادهها و مقایسه بین گروهها، آزمون تحلیل کوواریانس و آزمون تعقیبی بونفرونی در سطح معناداری 05/0P≤ استفاده شد. تمام محاسبات آماری با استفاده از نسخه 22 نرمافزار آماری SPSS صورت گرفت.
یافتهها
میانگین و انحراف معیار سنی آزمودنیهای سه گروه تمرین به همراه پیکولینات، تمرین به همراه دارونما و کنترل دیابتی به ترتیب 5/4±2/48، 9/7±2/55 و 2/11±5/56 سال بود. تمامی متغیرهای مطالعه حاضر توزیع طبیعی داشتند.
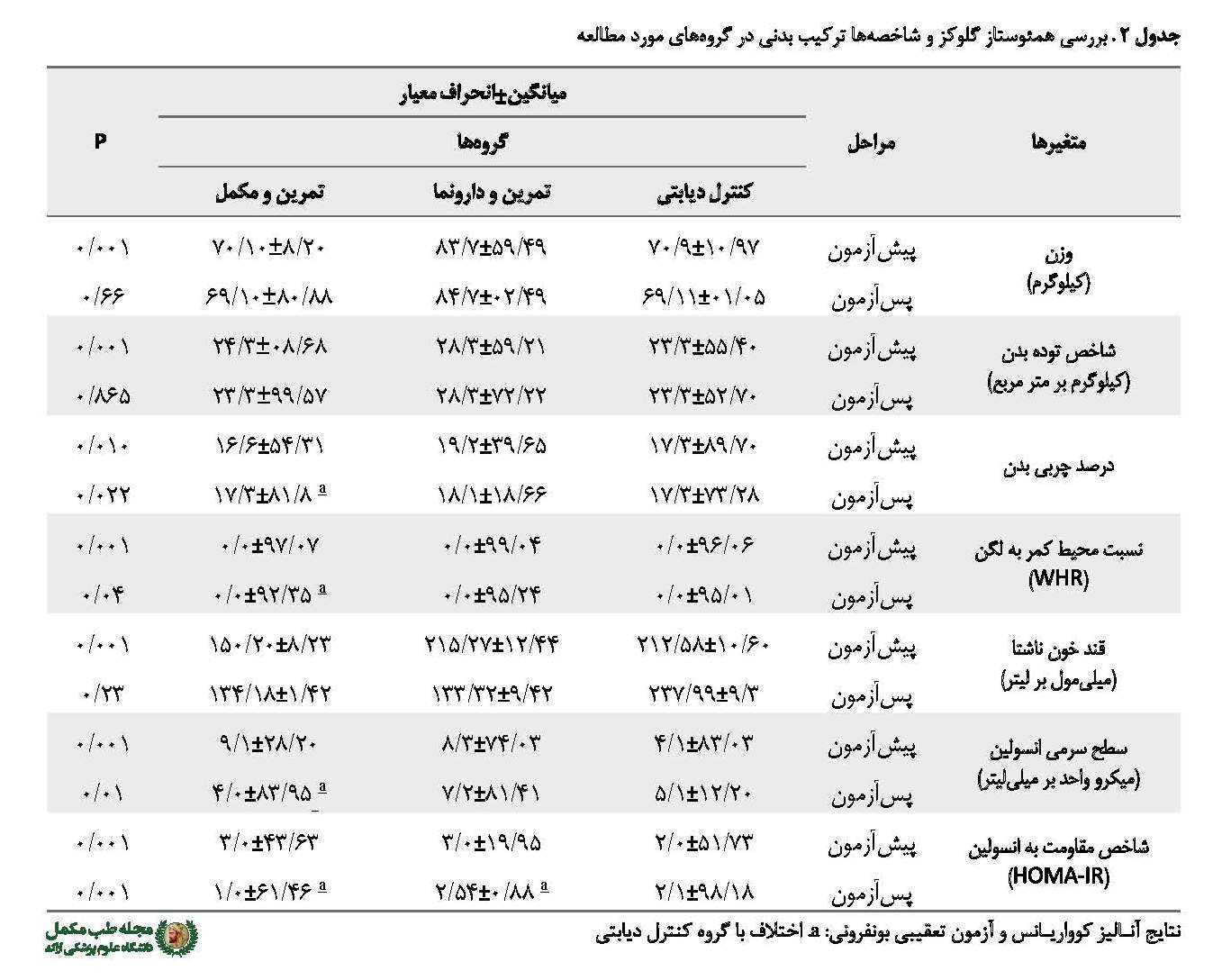
نتایج آزمون تحلیل واریانس یکطرفه نشان داد در پیشآزمون کلیه متغیرهای موردمطالعه تفاوت معناداری در بین گروهها وجود داد، بنابراین جهت بررسی پسآزمون این متغیرها از آزمون تحلیل کوواریانس استفاده شد و مقادیر پیشآزمون به عنوان متغیر همپراش در نظر گرفته شد. نتایج آزمون تحلیل کوواریانس نشان داد بین وزن (666/0=، P481/6=F) شاخص توده بدنی (865/0=, P481/6=F) در پسآزمون در گروههای مورد مطالعه تفاوت معناداری وجود ندارد، اما بین نسبت محیط کمر به لگن (04/0=, P481/6=F) تفاوت معناداری وجود دارد؛ به طوری که آزمون تعقیبی بونفرونی نشان داد نسبت محیط کمر به لگن در پسآزمون گروه تمرین به همراه مکمل پیکولینات نسبت به گروه کنترل دیابتی (041/0=P) کاهش معناداری یافته است. همچنین نتایج آزمون تحلیل کوواریانس نشان داد که بین درصد چربی در پسآزمون در گروههای مورد مطالعه تفاوت معناداری وجود دارد (022/0=, P44/4=F)، به طوری که آزمون تعقیبی بونفرونی نشان داد درصد چربی بدن در پسآزمون گروه تمرین به همراه مکمل پیکولینات نسبت به گروه کنترل دیابتی (019/0=P) کاهش معناداری یافته است (جدول شماره 2).
در خصوص متغیرهای همئوستاز گلوکز شامل قند خون ناشتا، انسولین و شاخص مقاومت انسولین نتایج آزمون تحلیل کوواریانس نشان داد که بین قند خون ناشتا (66/0=, P48/6=F) در پسآزمون در گروههای مورد مطالعه تفاوت معناداری وجود ندارد، اما مشاهده شد که سطح سرمی انسولین (001/0=, P97/116=F) و شاخص مقاومت انسولین (001/0=, P26/23=F) در پسآزمون گروههای مورد مطالعه تفاوت معناداری وجود دارد. با توجه به تفاوت معنادار بین متغیرهای مذکور در پسآزمون گروههای تحت بررسی، آزمون تعقیبی بونفرونی میانگینهای چندگانه مقایسه شد و نشان داد سطح سرمی انسولین (001/0=P) و شاخص مقاومت انسولین (001/0=P) در پسآزمون گروه تمرین به همراه مکمل پیکولینات و شاخص مقاومت انسولین (022/0=P) در گروه تمرین مقاومتی و دارونما نسبت به گروه کنترل دیابتی کاهش معناداری یافته است. همچنین شاخص مقاومت انسولین در پسآزمون گروه تمرین به همراه مکمل پیکولینات نسبت به گروه تمرین دارونما کاهش معناداری را نشان داد (045/0=P) (جدول شماره 2).
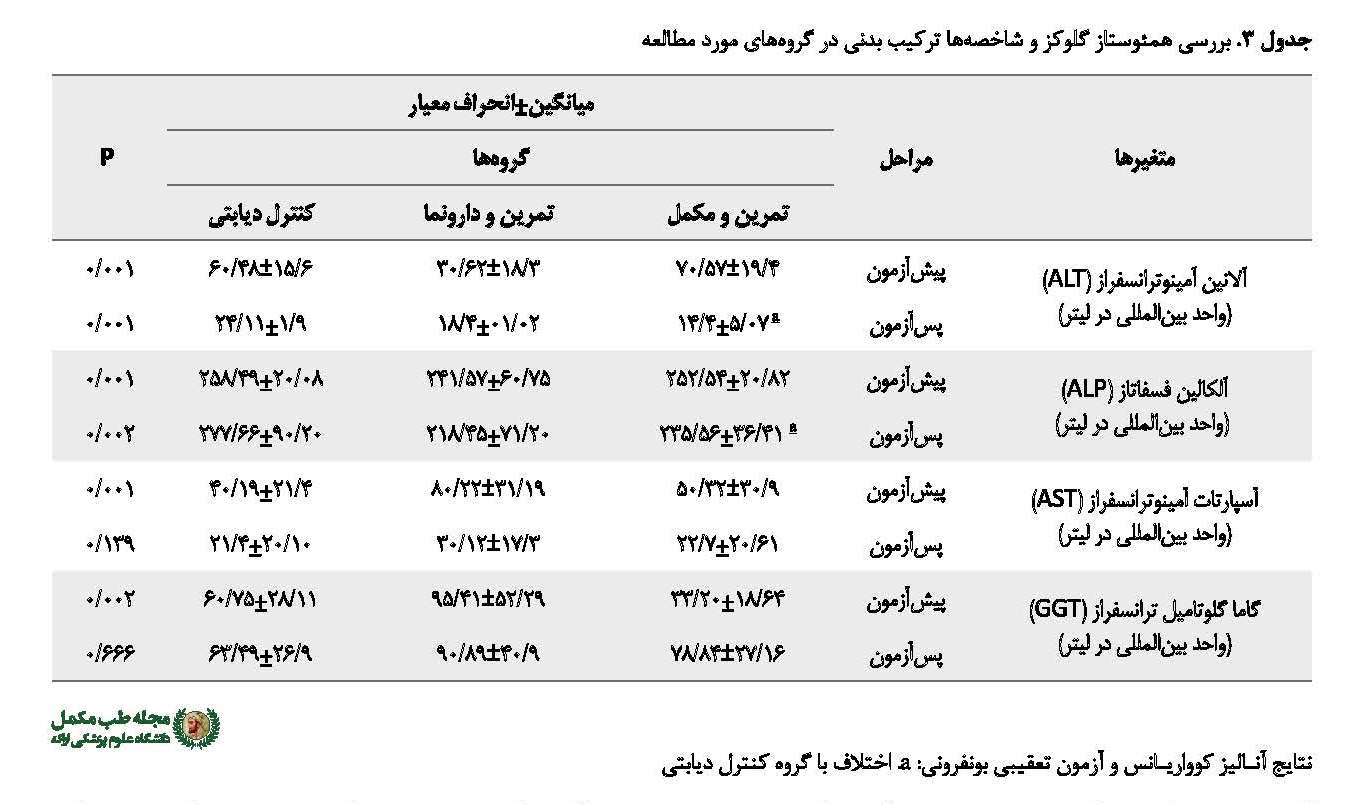
همچنین در مورد متغیرهای سطح سرمی آنزیمهای کبدی نتایج آزمون تحلیل کوواریانس نشان داد بین سطح سرمی آسپارتات آمینوترانسفراز (13/0=, P48/6=F) و سطح سرمی گاما گلوتامیل ترانسفراز (66/0=, P48/6=F) در پسآزمون در گروههای مورد مطالعه تفاوت معناداری وجود ندارد. اما نتایج آزمون تحلیل کوواریانس نشان داد که سطح سرمی آلانین آمینوترانسفراز (01/0=, P48/6=F) و سطح سرمی آلکالین فسفاتاز (02/0=, P48/6=F) در پسآزمون در گروههای مورد مطالعه تفاوت معناداری وجود دارد. با توجه به تفاوت معنادار بین متغیرهای مذکور در گروههای بررسیشده با آزمون تعقیبی بونفرونی میانگینهای چندگانه مقایسه شد و نشان داد سطح سرمی آلانین آمینوترانسفراز (001/0=P) و سطح سرمی آلکالین فسفاتاز (001/0=P) در پسآزمون گروه کنترل دیابتی نسبت به گروه تمرین به همراه مکمل پیکولینات بطور معناداری بیشتر بود. با وجود این، سطح سرمی آلانین آمینوترانسفراز (16/0=P) و سطح سرمی آلکالین فسفاتاز (09/0=P) در پسآزمون گروه تمرین به همراه مکمل پیکولینات نسبت به گروه تمرین به همراه دارونما تفاوت معناداری نداشتند (جدول شماره3).
بحث
نتایج پژوهش حاضر نشان داده است که تمرین مقاومتی به همراه مصرف مکمل پیکولینات کروم سبب کاهش معنیداری در سطوح آنزیمهای کبدی (AST و ALT) در مقایسه با گروه کنترل شده است. این دو آنزیم در گروه تمرین به همراه مکمل پیکولینات کاهش داشت، اما این کاهش نسبت به گروه تمرین مقاومتی و دارونما تفاوت معناداری را نشان نداد. همچنین با وجود کاهش در آنزیمهای GGT و AST این کاهش در گروههای مختلف تفاوت معناداری مشاهده نشد.
تغییرات شاخص گلیسمیکی و ترکیب بدنی پس از تمرین مقاومتی به همراه مصرف مکمل پیکولینات کروم نیز در تحقیق حاضر قابل توجه بود. به طوری که میزان قند خون ناشتا، انسولین و شاخص مقاومت به انسولین بعد از هشت هفته تمرین مقاومتی به همراه مصرف مکمل پیکولینات کروم کاهش معنیداری نسبت به گروه کنترل دیابتی را نشان داد که این کاهش نیز در شاخص مقاومت به انسولین، در گروه تمرین مقاومتی به همراه مصرف مکمل پیکولینات کروم نسبت به گروه تمرین مقاومتی به همراه دارونما نیز مشاهده شد. کاهش معنیدار در مقادیر وزن و شاخص توده بدنی، نسبت پس از تمرین مقاومتی به همراه مصرف مکمل پیکولینات کروم و همچنین تمرین و دارونما در مقایسه با گروه کنترل مشاهده نشد، اما درصد چربی بدن و دور شکم به دور لگن در هر دو گروه تمرین مقاومتی کاهش معناداری نسبت به گروه کنترل دیابتی یافت.
همخوان با نتایج مطالعه حاضر، یافتههای ارسلان و همکاران نشان داد مصرف مکمل کروم به همراه افزایش فعالیتهای بدنی در افراد دارای سندرم متابولیک میتواند سبب کاهش بافت چربی و افزایش توده عضلانی و سوخت بیشتر چربیهای بدن با بهبود سوختوساز گلوکز شود [12]. راسل و همکاران بیان میکنند که مکانیزمهایی که تغییرات کبدی را پس از یک برنامه تمرینی منظم تحت تأثیر قرار میدهند، احتمالاً منعکسکننده تغییرات حساسیت به انسولین، چربیهای گردش خون و تعادل انرژی هستند [19].
حساسیت به انسولین نقش مهمی در هموستاز داخلی چربی کبدی ایفا میکند. یافتههای ما نیز از گزارشهای دیگر پشتیبانی میکند، به طوری که استرینبرگ و همکاران بیان کردند برنامه تمرینی منظم باعث کاهش گلوکز خون از طریق افزایش جذب آن در بافتهای بدن میشود که حداقل تا حدودی به دلیل افزایش بیان ژن ناقلین گلوکز نوع 4 (GLUT4) در عضلات اسکلتی، گیرنده انسولین و ذخیرهسازی گلیکوژن است [20]. همچنین همخوان با نتایج مطالعه حاضر، شمسالدینی و همکاران گزارش دادند یک برنامه هشتهفتهای تمرین مقاومتی در مردان دارای کبد چرب غیرالکلی، موجب بهبود سطوح سرمی ALT و AST و شاخص مقاومت به انسولین همراه با کاهش توده چربی میشود [21]. اما مخالف نتایج ما، زِلبِر و همکاران که به بررسی اثر سه ماه تمرین مقاومتی بر آنزیمهای کبدی بیماران مبتلا به کبد چرب پرداختند، مشاهده کردند که سه ماه تمرین مقاومتی، تأثیری بر این آنزیمها نداشته است و علت این موضوع را شاید بتوان به این نسبت داد که درصد چربی این افراد پس از اجرای برنامه تمرین، تفاوت معناداری با گروه کنترل نداشت [22].
از طرفی کبد در شرایط تغییرات متابولیکی که در طول تمرینات ورزشی بوجود میآید از طریق کنترل گلوکونئوژنز و تولید گلوکز به خون نقش مهمی در حفظ گلیسمی دارد [23]. علاوه بر این در اختلالات متابولیکی مانند دیابت، کبد در معرض افزایش استرس اکسیداتیو و کاهش ظرفیت دفاعی آنتی اکسیدان است [24]. به طوری که در مطالعه اسچمازت و همکاران مشاهده کردن با تجویز مکمل رزوراتول موجب بهبود بیومارکرهای استرس اکسیداتیو و متعاقب آن کاهش AL، ASTدر کبد موشهای صحرایی دیابتی شد [25]. علاوه بر این فعالیت ورزشی به افزایش ظرفیت دفاعی آنتیاکسیدانتی و متعاقب آن دو نقش پیشگیری و درمانی در بیماریهای عمده مرتبط با استرس اکسیداتیو دارد [27 ،26].
همچنین نتایج ما نشان داد علاوه بر تغییرندادن معناداری در وزن و شاخص توده بدنی، درصد توده چربی بدن در گروه تمرین مقاومتی به همراه مصرف مکمل پیکولینات کروم و همچنین تمرین و دارونما در مقایسه با گروه کنترل کاهش معناداری یافته است. عدم از دست دادن وزن و کاهش شاخص توده بدن با تمرینات مقاومتی در یافتههای این مطالعه با دیگر مطالعات همخوانی دارد زیرا این موضوع میتواند به دلیل ماهیت تمرینات مقاومتی باشد که علاوه بر کاهش درصد چربی بدن این تمرینات میتوانند توده عصلانی را نیز افزایش دهند [28].
مطالعه حاضر نشان داد که هشت هفته تمرین مقاومتی به همراه مصرف مکمل پیکولینات کروم به میزان قابل توجهی چاقی شکمی (به وسیله اندازهگیری نسبت محیط شکم به محیط لگن) و درصد چربی بدن زیر پوستی را کاهش میدهد. همخوان با این نتایج در مطالعه الیوسا و همکاران گزارش کردند که که یک برنامه شانزدههفتهای تمرین مقاومتی متعاقب کاهش درصد چربی بدن و WHR موجب کاهش مقاومت به انسولین در مردان دیابتی نوع 2 میشود [29].
اهمیت چربی احشایی و مقاومت به انسولین و ارتباط آن با خطر بیماریهای کبدی به اثبات رسیده است. همچنین شناخته شده است که تمرینات ورزشی هوازی میتواند به طور قابل توجهی کاهش چربی احشایی و به طور مداوم حساسیت به انسولین را بهبود بخشد [30]. البته مطالعات کنترلشده به طور تصادفی کمتر اثرات تمرین مقاومتی بر چربی احشایی در افراد دارای چاق مبتلا به دیابت را بررسی کردهاند. به طوری که مخالف نتایج مطالعه حاضر دیویدسون و همکاران تأثیر معناداری بر چربی احشایی مشاهده نکردند [31]. با این وجود، طراحی مطالعه آنها شامل تنها 20 دقیقه تمرین مقاومتی، سه بار در هفته بود و بنابراین شاید تفاوت در اجرای پروتکل تمرینات مقاومتی و همچنین تفاوت در جامعه و نمونه علت این اختلاف باشد.
درنهایت اشاره به این موضوع از اهمیت فوقالعادهای برخوردار است که یکی از مهمترین علل بهوجودآمدن آسیبهای کبدی مقاومت به انسولین است که با عوامل مختلف سندرم متابولیک در ارتباط است. این وضعیت حتی در شرایط نبود چاقی، اضافه وزن و دیابت نوع 2 مشاهده شده است و مطالعات بهوضوح رابطه منفی بین تجمع چربی و التهاب در کبد با حساسیت به انسولین را به اثبات رساندهاند [32].
نتیجه گیری
به طور کلی تمرینات ورزشی مقاومتی بهتنهایی میتواند تأثیرات مطلوبی روی شاخصهای کبدی و بهبود ترکیب بدنی بگذارد و همچنین مصرف پیکولینات کروم میتواند سبب بهبود شاخصهای کبدی در مردان دیابتی نوع 2 شود، ولی ترکیب تمرین مقاومتی با مصرف مکمل پیکولینات کروم تأثیر بسزایی بر بهبود ترکیب بدنی و شاخصهای کبدی در مردان دیابتی نوع 2 دارد.
در مورد محدودیتهای مطالعه حاضر، میتوان به اندازه کوچک حجم نمونه این مطالعه اشاره کرد که یک محدودیت در نظر گرفته میشود. بدون شک، مطالعه بیشتر و حجم نمونه بالاتر برای افزایش اعتبار یافتههای ما ضروری است. از دیگر محدویتهای تحقیق میتوان به حالات روحی و روانی آزمودنها اشاره کرد. همچنین در مطالعه حاضر، مطالعه بافتشناسی کبد به خاطر اجرای پروتکلهای اخلاقی انجام نشد، بنابراین امکان بررسی دادههای مربوط به بافتشناسی کبد جهت تأیید نتایج تحقیق حاضر مقدور نشد.
با توجه به نتایج مطالعه به نظر میرسد اثر تمرین مقاومتی و مصرف مکمل پیکولینات کروم روی سطوح سرمی بر آنزیمها و اختلالات کبدی مردان دیابتی نوع 2، مطالعات کمی صورت گرفته است، بنابراین مطالعات بیشتری لازم است تا به طور عمیقتر سازوکارهای مؤثر بر تغییرات این آنزیمها بررسی شود. از این رو جهت روشنشدن و تأیید اثر مکمل پیکولینات کروم همراه با فعالیت بدنی بر آنزیمهای کبدی، استفاده از روشهای تمرینی دیگر در مطالعات آینده پیشنهاد میشود.
پیروی از اصول اخلاق پژوهش
کد اخلاق به شرح (IR.Arakmu.rec.1397.172) در کمیته اخلاق طرحهای پژوهشی دانشگاه علوم پزشکی اراک اخذ شده است.
حامی مالی
این تحقیق هیچگونه کمک مالی از سازمانهای تأمین مالی در بخشهای عمومی دریافت نکرده است.
مشارکت نویسندگان
تمام نویسندگان در آمادهسازی این مقاله مشارکت داشتهاند و مدیریت پروژه پژوهشی بر عهده آقای محمد پرستش بوده است.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
تشکر و قدردانی
بدینوسیله از همکاری صمیمانه همه عزیزان در دانشکده علوم ورزشی اراک و دانشگاه علوم پزشکی اراک، که ما را در انجام این مطالعه یاری رساندند، سپاسگزاریم.
References
Shi GJ, Shi GR, Zhou JY, Zhang WJ, Gao CY, Jiang YP, et al. Involvement of growth factors in diabetes mellitus and its complications: A general review. Biomedicine & Pharmacotherapy. 2018; 101:510-27. [DOI:10.1016/j.biopha.2018.02.105] [PMID]
Shi GJ, Zheng J, Wu J, Qiao HQ, Chang Q, Niu Y, et al. Beneficial effects of Lycium barbarum polysaccharide on spermatogenesis by improving antioxidant activity and inhibiting apoptosis in streptozotocin-induced diabetic male mice. Food & Function. 2017; 8(3):1215-26. [DOI:10.1039/C6FO01575A] [PMID]
Dehdashtian E, Mehrzadi S, Yousefi B, Hosseinzadeh A, Reiter RJ, Safa M, et al. Diabetic retinopathy pathogenesis and the ameliorating effects of melatonin; involvement of autophagy, inflammation and oxidative stress. Life Sciences. 2018; 193:20-33. [DOI:10.1016/j.lfs.2017.12.001] [PMID]
Shi GJ, Li Y, Cao QH, Wu HX, Tang XY, Gao XH, et al. In vitro and in vivo evidence that quercetin protects against diabetes and its complications: A systematic review of the literature. Biomedicine & Pharmacotherapy. 2019; 109:1085-99. [DOI:10.1016/j.biopha.2018.10.130] [PMID]
König M, Bulik S, Holzhütter HG. Quantifying the contribution of the liver to glucose homeostasis: A detailed kinetic model of human hepatic glucose metabolism. PLoS Computational Biology. 2012; 8(6):e1002577. [DOI:10.1371/journal.pcbi.1002577] [PMID] [PMCID]
Ahangarpour A, Shabani R, Farbood Y. The effect of betulinic acid on leptin, adiponectin, hepatic enzyme levels and lipid profiles in streptozotocin-nicotinamide-induced diabetic mice. Research in Pharmaceutical Sciences. 2018; 13(2):142-8. [DOI:10.4103/1735-5362.223796] [PMID] [PMCID]
Khalili M, Shuhart MC, Lombardero M, Feld JJ, Kleiner DE, Chung RT, et al. Relationship between metabolic syndrome, alanine aminotransferase levels, and liver disease severity in a multiethnic North American cohort with chronic Hepatitis B. Diabetes Care. 2018; 41(6):1251-9. [DOI:10.2337/dc18-0040] [PMID] [PMCID]
Cefalu WT, Hu FB. Role of chromium in human health and in diabetes. Diabetes Care. 2004; 27(11):2741-51. [DOI:10.2337/diacare.27.11.2741] [PMID]
Wang ZQ, Cefalu WT. Current concepts about chromium supplementation in type 2 diabetes and insulin resistance. Current Diabetes Reports. 2010; 10(2):145-51. [DOI:10.1007/s11892-010-0097-3] [PMID]
Jain SK, Kahlon G, Morehead L, Dhawan R, Lieblong B, Stapleton T, et al. Effect of chromium dinicocysteinate supplementation on circulating levels of insulin, TNF-α, oxidative stress, and insulin resistance in type 2 diabetic subjects: Randomized, double‐blind, placebo‐controlled study. Molecular Nutrition & Food Research. 2012; 56(8):1333-41. [DOI:10.1002/mnfr.201100719] [PMID] [PMCID]
Nourmohammadi L, Kocheki-Shalmani I, Shaabani M, Gohari L, Nazari H. Zinc, copper, chromium, manganese and magnesium levels in serum and hair of insulin-dependent diabetics. 2000.
Arslan F, Güven ŞD, Özcan A, Vatansev H, Taşgin Ö. The effect of exercise, reflexology and chrome on metabolic syndrome. International Journal of Medical Research & Health Sciences. 2018; 7(8):77-85.
Roessner C, Paasch U, Kratzsch J, Glander HJ, Grunewald S. Sperm apoptosis signalling in diabetic men. Reproductive Biomedicine Online. 2012; 25(3):292-9. [DOI:10.1016/j.rbmo.2012.06.004] [PMID]
Scherrenberg M, Dendale P. Exercise training in diabetes. European Journal of Preventive Cardiology. 2019; 26(7):698-700. [DOI:10.1177/2047487319829674] [PMID]
Cauza E, Hanusch-Enserer U, Strasser B, Ludvik B, Metz-Schimmerl S, Pacini G, et al. The relative benefits of endurance and strength training on the metabolic factors and muscle function of people with type 2 diabetes mellitus. Archives of Physical Medicine and Rehabilitation. 2005; 86(8):1527-33. [DOI:10.1016/j.apmr.2005.01.007] [PMID]
Cassidy S, Thoma C, Hallsworth K, Parikh J, Hollingsworth KG, Taylor R, et al. High intensity intermittent exercise improves cardiac structure and function and reduces liver fat in patients with type 2 diabetes: A randomised controlled trial. Diabetologia. 2016; 59(1):56-66. [DOI:10.1007/s00125-015-3741-2] [PMID] [PMCID]
Saremi A, Parastesh M. Twelve-week resistance training decreases myostatin level and improves insulin sensitivity in overweight-obese women. International Journal of Diabetes and Metabolism. 2011; 19:63-8.
Swain DP, American College of Sports Medicine. ACSM’s resource manual for guidelines for exercise testing and prescription. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins; 2014.
Russell-Guzmán J, Karachon L, Gacitúa T, Freundlich A, Poblete-Aro C, Rodrigo R. Role of exercise in the mechanisms ameliorating hepatic steatosis in non-alcoholic fatty liver disease. Sport Sciences for Health. 2018; 14(3):463-73. [DOI:10.1007/s11332-018-0459-9]
Steenberg DE, Jørgensen NB, Birk JB, Sjøberg KA, Kiens B, Richter EA, et al. Exercise training reduces the insulin‐sensitizing effect of a single bout of exercise in human skeletal muscle. The Journal of Physiology. 2019; 597(1):89-103. [DOI:10.1113/JP276735] [PMID]
Shamsoddini AR, Sobhani V, Ghamar Chehreh ME, Alavian SM, Zaree A. Effect of aerobic and resistance exercise training on liver enzymes and hepatic fat in Iranian men with nonalcoholic fatty liver disease. Hepatitis Monthly. 2015; 15(10):e31434. [DOI:10.5812/hepatmon.31434] [PMID] [PMCID]
Zelber-Sagi Sh, Buch A, Yeshua H, Vaisman N, Webb M, Harari G, et al. Effect of resistance training on non-alcoholic fatty-liver disease a randomized-clinical trial. World Journal of Gastroenterology. 2014; 20(15):4382-92. [DOI:10.3748/wjg.v20.i15.4382] [PMID] [PMCID]
Gonzalez JT, Fuchs CJ, Betts JA, Van Loon LJ. Liver glycogen metabolism during and after prolonged endurance-type exercise. American Journal of Physiology-Endocrinology and Metabolism. 2016; 311(3):E543-E53. [DOI:10.1152/ajpendo.00232.2016] [PMID]
George N, Kumar TP, Antony S, Jayanarayanan S, Paulose C. Effect of vitamin D 3 in reducing metabolic and oxidative stress in the liver of streptozotocin-induced diabetic rats. British Journal of Nutrition. 2012; 108(8):1410-8. [DOI:10.1017/S0007114511006830] [PMID]
Schmatz R, Perreira LB, Stefanello N, Mazzanti C, Spanevello R, Gutierres J, et al. Effects of resveratrol on biomarkers of oxidative stress and on the activity of delta aminolevulinic acid dehydratase in liver and kidney of streptozotocin-induced diabetic rats. Biochimie. 2012; 94(2):374-83. [DOI:10.1016/j.biochi.2011.08.005] [PMID]
Oh S, Tanaka K, Warabi E, Shoda J. Exercise reduces inflammation and oxidative stress in obesity-related liver diseases. Medicine and Science in Sports and Exercise. 2013; 45(12):2214-22. [DOI:10.1249/MSS.0b013e31829afc33] [PMID]
Chiş IC, Mureşan A, Oros A, Nagy AL, Clichici S. Protective effects of Quercetin and chronic moderate exercise (training) against oxidative stress in the liver tissue of streptozotocin-induced diabetic rats. Acta Physiologica Hungarica. 2016; 103(1):49-64. [DOI:10.1556/036.103.2016.1.5] [PMID]
Sigal RJ, Alberga AS, Goldfield GS, Prud’homme D, Hadjiyannakis S, Gougeon R, et al. Effects of aerobic training, resistance training, or both on percentage body fat and cardiometabolic risk markers in obese adolescents: the healthy eating aerobic and resistance training in youth randomized clinical trial. JAMA Pediatrics. 2014; 168(11):1006-14. [DOI:10.1001/jamapediatrics.2014.1392] [PMID]
Olioso D, Dauriz M, Bacchi E, Negri C, Santi L, Bonora E, et al. Effects of aerobic and resistance training on circulating micro-RNA expression profile in subjects with type 2 diabetes. The Journal of Clinical Endocrinology & Metabolism. 2019; 104(4):1119-30. [DOI:10.1210/jc.2018-01820] [PMID]
Slentz CA, Bateman LA, Willis LH, Shields AT, Tanner CJ, Piner LW, et al. Effects of aerobic vs. resistance training on visceral and liver fat stores, liver enzymes, and insulin resistance by HOMA in overweight adults from STRRIDE AT/RT. American Journal of Physiology-Endocrinology and Metabolism. 2011; 301(5):E1033-E9. [DOI:10.1152/ajpendo.00291.2011] [PMID] [PMCID]
Davidson LE, Hudson R, Kilpatrick K, Kuk JL, McMillan K, Janiszewski PM, et al. Effects of exercise modality on insulin resistance and functional limitation in older adults: A randomized controlled trial. Archives of Internal Medicine. 2009; 169(2):122-31. [DOI:10.1001/archinternmed.2008.558] [PMID]
Chalasani N, Younossi Z, Lavine JE, Diehl AM, Brunt EM, Cusi K, et al. The diagnosis and management of non‐alcoholic fatty liver disease: Practice guideline by the American Association for the study of liver diseases, American college of gastroenterology, and the American gastroenterological association. Hepatology. 2012; 55(6):2005-23. [DOI:10.1002/hep.25762] [PMID]


 1، عباس صارمی2
1، عباس صارمی2 

 ، میثم عبادینژاد3
، میثم عبادینژاد3 


