مقدمه
بیماری کبد چرب غیرالکلی یک اختلال مزمن کبدی است که با انباشت چربی در کبد همراه است. NAFLD باعث طیف گستردهای از اثرات پاتولوژیک مانند استئاتوهپاتیت غیرالکلی، سیروز، مقاومت به انسولین، چاقی، فشار خون بالا، دیابت و بیماری قلبی میشود [1]. بافت کبد نقش مهمی در کنترل سوختوساز بدن داشته و کبد چرب منجر به ایجاد سندرم متابولیکی و دیس لیپیدمی میشود [2]. این اختلالات متابولیکی میتواند بر پویایی میتوکندری تأثیر داشته باشد [3]. پویایی میتوکندریایی شامل فرایند شکاف و همجوشی است که مهمترین پروتئینهای همجوشی MFn1 و MFn2 هستند [4].
کاهش پروتئینهای همجوشی در بیماری کبد چرب به دلیل افزایش چربی است که موجب اختلال در عملکرد میتوکندری، ازدستدادن پتانسیل غشا، کاهش اکسیژن و افزایش تولید گونههای فعال اکسیژن میشود [5, 6]. عدم تعادل در پروتئینهای همجوشی MFn1 ،MFn2 و شکافت، باعث بههمریختگی ساختاری میتوکندری، اختلالات متابولیسمی تجزیه میتوکندریها، آپوپتوز و حتی مرگ سلولی میشود [7]. اختلال در عملکرد میتوکندری ممکن است نهتنها باعث تجمع چربی شود، بلکه ROS و سایتوکاینهای را که باعث پیشرفت NAFLD و فیبروز کبدی میشود افزایش دهد [8].
مطالعات نشان دادهاند تغییر شکل ساختار میتوکندری در بیماران NAFLD وجود دارد [10 ،9]. در بیماران کبد چرب غیرالکلی و چاقی، مهار MFn2 باعث کاهش اکسیداسیون سوبسترا و سوختوساز سلولی بدن، کاهش پتانسیل غشا و زنجیره انتقال الکترون میشود [11]. جلوگیری از همجوشی میتوکندری در بیماریهای کبد چرب منجر به کاهش تنفس میتوکندری میوسیتهای قلبی و افزایش حساسیت به استرس اکسیداتیو میشود [11].
مطالعات نشان دادند فعالیت ورزشی، عملکرد میتوکندری را بهبود میبخشد. از این رو به نظر میرسد که فعالیت ورزشی نهتنها تعداد این اندامکها را افزایش میدهد، بلکه کیفیت میتوکندری را نیز بهبود میبخشد. این بهبود عملکرد میتوکندری با افزایش سطوح بیوژنز میتوکندری و حذف میتوکندری آسیبدیده به دست میآید [12].
به طور کلی با توجه تحقیقات انجامشده گزارش شده است که فعالیتهای هوازی منظم میتواند باعث کاهش چربی و آسیبپذیری کبد شده و التهاب را در کبد چرب غیرالکلی کاهش میدهد. همچنین با توجه به تحقیقات انجامشده گزارش شده است که عصاره انگور و رزوراترول هم با توجه به داشتن ترکیبات پلیفنول میتواند باعث کاهش آسیبپذیری کبد چرب و پویایی میتوکندری در میوسیتهای قلبی شود [13]. مطالعات تجربی اثرات سودمند این ماده را در ممانعت از تجمع چربی و کاهش استرس اکسیداتیو در هپاتیت و همچنین پیشگیری و درمان کبد چرب در مدلهای حیوانی نشان داده است [14].
اثر بخشی رزوراترول احتمالاً به دلیل توانایی برای برطرفکردن بدن از ROS و مهار سیکلواکسیژناز و فعالشدن بسیاری از مسیرهای ضدالتهابی است [15]. با توجه به مطالعات بیانشده اثر فعالیتهای هوازی و رزوراترول، هرکدام بهتنهایی بر کبد چرب غیرالکلی بررسی شده است. با وجود این محقق، نتوانسته است مطالعهای را که به صورت همزمان به بررسی اثر تمرین هوازی و رزوراترول بر شاخصهای MFn1، MFn2 بپردازد، پیدا کند. اگرچه ارتباط بین کبد چرب غیرالکلی و بیماری قلبیعروقی در تحقیقات بررسی شده است، اما مکانیسم آن بهخوبی روشن نشده است. مطالعات نشان دادند افزایش سطح اکسیداتیو ناشی از تولید بیش از حد رادیکالهای آزاد، پاسخهای شدید التهابی، کاهش ظرفیت آنتیاکسیدان داخل سلولی و القای آپوپتوز سلولی احتمالاً به عنوان مکانیسم اصلی پیشرفت بیماری کبد چرب غیرالکلی است و ممکن است با مشکلات قلبی ناشی از کبد چرب غیرالکلی همراه باشد [3].
در پژوهشی لیو و همکاران بیان کردند بیماران کبد چرب غیرالکلی، در معرض افزایش بیماریهای قلبیعروقی هستند و ارتباط تنگاتنگی بین بیماری کبد چرب غیرالکلی و مشکلات قلبی وجود دارد [16]. در بیماری کبد چرب افزایش استرس اکسیداتیو، باعث عدم تعادل در پروتئینهای همجوشی و شکافتشده و باعث بههمریختگی ساختاری میتوکندری و تجزیه میتوکندریها و حتی مرگ سلولی میشود [17]. آرچل و همکاران بیان کردند که تغییرات پروتئینهای همجوشی و شکافت در بیماری قلبی رخ میدهد [18].
مطالعات اخیر نشان دادند که یک ارتباط دوطرفه قوی بین بیماری کبد چرب و بیماریهای قلبیعروقی وجود دارد. به عبارتی، بیماری کبد چرب میتواند منجر به افزایش خطر ابتلا به بیماریهای قلبیعروقی شود [19]. محققان در تحقیقات زیست پزشکی گزارش کردند یکی از عواملی که باعث محافظت در برابر بیماری کبد چرب غیرالکلی میشود، پروتئین میتوفیوزین MFn2 است. در انسانها و موشها، هنگامیکه سطح میتوفیوزین MFn2 کاهش مییابد به این بیماری دچار میشوند [20]. با توجه به موارد ذکرشده، فرض محقق این است که تمرین هوازی همراه با مکمل رزوراترول اثر بهتری نسبت به هرکدام بهتنهایی (تمرین و رزوراترول) بر ژنهای همجوشی میوسیتهای میتوکندری قلبی داشته باشد. بنابراین هدف از پژوهش حاضر بررسی اثر تمرین هوازی همراه با مکمل رزوراترول بر بیان MFn1 و MFn2 میوسیتهای میتوکندری قلبی در مدل حیوانی کبد چرب غیرالکلی بود.
مواد و روشها
نمونهها
روش پژوهش از نوع تجربی است. در این پژوهش تعداد 48 سر موش صحرایی نر هشتهفتهای از نژاد ویستار به عنوان نمونه انتخاب و به مرکز پژوهش منتقل شدند. حجم نمونه مطالعه حاضر بر اساس نتایج تحقیقات پیشین، در سطح معنیداری پنج درصد (خطای نوع اول) و توان آماری 95 درصد (خطای نوع دوم) و با استفاده از نسخه 18/2/1 نرمافزار Medcalc (هشت سر موش در هر گروه) تعیین شد. معیار ورود به مطالعه حاضر شامل نربودن موشها، سلامت کامل موشها و عدم استفاده از هرگونه دارو بود.
معیار خروج از مطالعه عدم اجرای پروتکل تمرینی و مصرفنکردن مکمل، مؤنثبودن و آسیب حین اجرای تمرین بود. حیوانات در دمای 2±22 درجه سانتیگراد، رطوبت 5±55 درصد و چرخه تاریکی به روشنایی 12:12 ساعته نگهداری شدند. در تمام مدت آب و غذا (به صورت پلت) به اندازه کافی و آزادانه دریافت کردند. موازین اخلاقی کار با حیوانات، مطابق کمیته اخلاقی دانشگاه آزاد اسلامی واحد ساری رعایت و تأیید شد. پس از انتقال موشهای صحرایی به آزمایشگاه، القای کبد چرب غیرالکلی و آشنایی با فعالیت ورزشی روی تردمیل مخصوص جوندگان، به طور تصادفی به دو گروه بیمار و کنترل ـ سالم (CN) تقسیم شدند. موشهای صحرایی در گروه کنترل به مدت شش هفته تحت رژیم غذایی استاندارد (شامل 12 درصد چربی، 57 درصد کربوهیدرات، 28 درصد پروتئین، و 3 درصد سایر موارد) قرار گرفتند، در حالی که جهت القای NAFLD در موشها، حیوانات به مدت شش هفته تحت رژیم غذایی پرچرب (شامل 22 درصد چربی، 50 درصد کربوهیدرات، 24 درصد پروتئین و 4 درصد سایر موارد) قرار گرفتند [21]. موشهای صحرایی گروه بیمار مجدداً به پنج زیرگروه تجربی شامل: بیمار (NAFLD)، شم (SHAM)، تمرین ـ بیمار (P)، مکمل ـ بیمار (SUPNAF) و تمرین ـ مکمل ـ بیمار (TRSUPNAF) تقسیم شدند. موشهای صحرایی گروه تمرین، یک برنامه هشت هفتهای (پنج روز هفته) تمرین هوازی را اجرا کردند، در حالی که دیگر موشهای صحرایی در هیچ برنامه تمرینی شرکت داده نشدند.
پروتکل تمرین
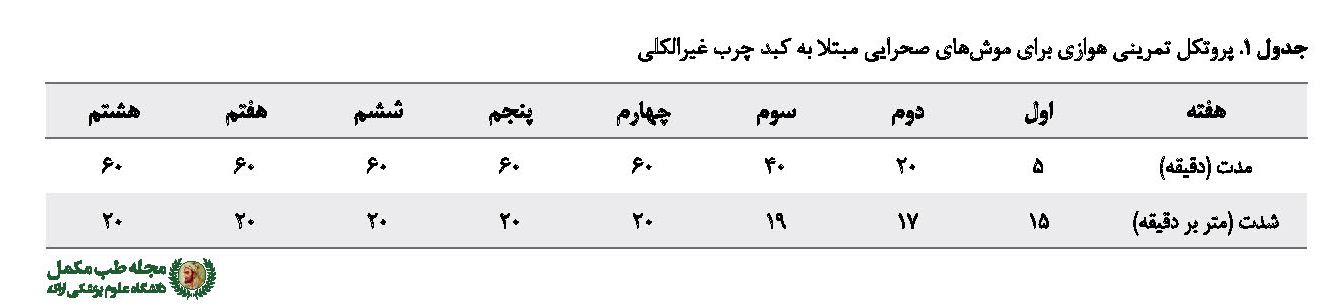
جدول شماره 1 پروتکل تمرین هوازی را برای موشهای صحرایی مبتلا به NAFLD نشان داده است. قبل از شروع تمرین اصلی و به منظور آشنایی با چگونگی فعالیت توسط تردمیل، موشهای صحرایی گروههای تمرین و گروه مکمل ـ تمرین در یک هفته طی پنج جلسه، به مدت پنج دقیقه با سرعت 8 تا 10 متر بر دقیقه با شیب صفر فعالیت داشتند. برنامه تمرین اصلی به مدت هشت هفته بود؛ بدین صورت که در هفته آغازین با سرعت 15 متر بر دقیقه، زمان 5 دقیقه شروع و هر جلسه به سرعت، 1 تا 2 متر بر دقیقه و به زمان نیز 2 تا 4 دقیقه افزوده شد؛ به طوری که در هفته چهارم سرعت به 20 متر بر دقیقه و زمان به 60 دقیقه رسید. شدت و زمان تمرین تا هفته آخر ثابت ماند [22]. همچنین پنج دقیقه قبل و بعد از تمرین برای گرم و سردکردن حیوانات در نظر گرفته شد.

نحوه مصرف رزوراترول
میزان یک گرم پودر رزوراترول (شرکت نوترابیو آمریکا، با درجه فارماکولوژی و خلوص 99/87 درصد) با غلظت 10 میلیگرم در میلیمول به عنوان استوک ساخته شد. برای هربار تجویز رزوراترول، 100 میکرولیتر اتانول هفت درصد یا DMSO 10 درصد در آب به ازای هر موش صحرایی تهیه و رزوراترول را در آن معلق و تجویز شد. برای کاهش درصد خطا برای کلیه آزمودنیها محلول به صورت یکجا تهیه شد و در گروههای SUPNAF و TRSUPNAF با دُز 20 میلیگرم به ازای هر کیلوگرم وزن بدن (رأس ساعت 9 صبح) به صورت درونصفاقی به مدت هشت هفته به نمونهها تزریق شد [23].
روش نمونهگیری از بافت قلب و اندازهگیری متغیرها
پس از اعمال متغیر مستقل، تمام نمونهها با شرایط کاملاً مشابه و در شرایط پایه (48 ساعت پس از آخرین جلسه تمرینی و 12 تا 14 ساعت ناشتایی) با تزریق داخل صفاقی ترکیبی از کتامین (60 میلیگرم / کیلوگرم وزن بدن) و زایلازین (5 میلیگرم / کیلوگرم وزن بدن) بیهوش شدند. بافت مدنظر بلافاصله پس از جداسازی و شستوشو با سالین فوراً در تیوبهای حاوی RNA later جهت جلوگیری از تخریب RNA قرار داده شد و به نیتروژن مایع منتقل و سپس در یخچال در دمای منهای 80 درجه سانتیگراد تا زمان اندازهگیری نگهداری شد. برای جلوگیری از تأثیر آهنگ شبانهروزی، نمونهگیری از ساعت 8 آغاز و 11:30 به اتمام رسید. برای بررسی بیان MFn1 و MFn2 در هر گروه از تکنیک PCR Real Time استفاده شد. ابتدا طراحی پرایمر انجام شد و سپس RNA کل از بافتها استخراج شد و به cDNA تبدیل شد. سپس cDNA به روش PCR تکثیر شد و از نظر بیان ژنهای ذکرشده مورد بررسی قرار گرفت.
روش اندازهگیری بیان MFn1 و MFn2
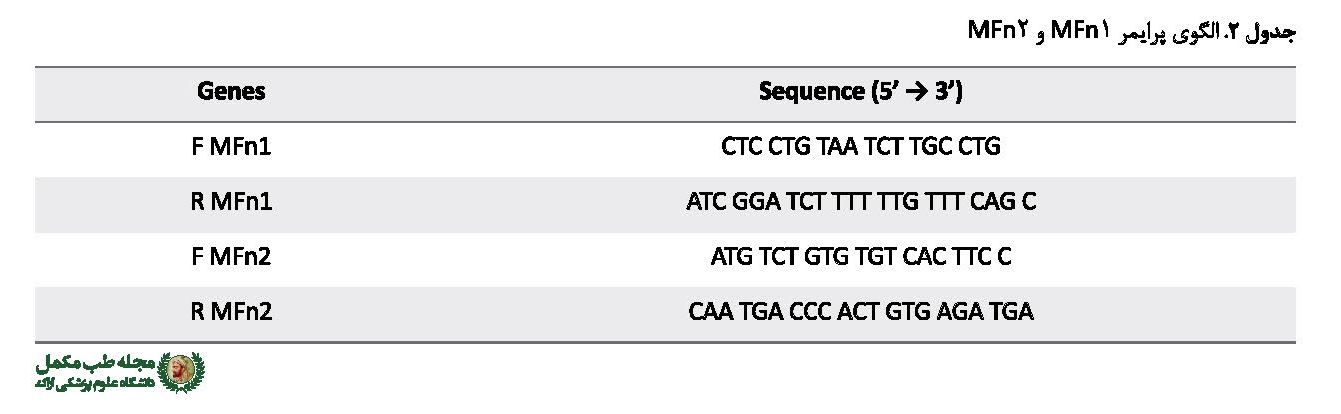
جدول شماره 2 الگوی پرایمر را نمایش میدهد.
استخراج RNA
RNA با استفاده از کیت کیاژن (آلمان) و مطابق با دستورالعمل شرکت سازنده استخراج شد.
انجام Real time-PCR
پس از استخراج RNA با خلوص و غلظت بالا از تمامی نمونههای موردمطالعه، مراحل سنتز cDNA طبق پروتکل شرکت سازنده (Fermentas, USA) انجام گرفت و سپس cDNA سنتزشده جهت انجام واکنش رونویسی معکوس مورد استفاده قرار گرفت. ابتدا کلیه پرایمرهای طراحیشده مربوط به تمامی ژنها، مورد بررسی قرار گرفت و سپس بررسی بیان ژنها با استفاده از روش کمّی q-RT PCR انجام گرفت.
تجزیه و تحلیل آماری
پس از تأیید توزیع نرمال دادهها با استفاده از آزمون شاپیرو ویلک و همگنی واریانسها توسط از آزمون لون، برای تجزیه و تحلیل آماری از آزمون تحلیل واریانس یکطرفه و آزمون تعقیبی توکی استفاده شد. تمام دادهها بهصورت میانگین ± انحراف معیار ارائه شد. محاسبات با استفاده از نسخه 16 نرمافزار آماری SPSS انجام شد و سطح معنیداری آزمونها P≤0/05 در نظر گرفته شد.
یافتهها
تجزیه و تحلیل دادهها نشان داد تفاوت معنیدار در میزان تغییرات بیان MFn1 کاردیومیوسیتها بین گروههای مختلف وجود دارد P=0/001 و 11/743=F (جدول شماره 3). نتایج آزمون تعقیبی توکی نشان داد بین گروههای CN با NAFLD و P=0/001 SHAM P=0/001تفاوت معنیداری وجود دارد. همچنین بین گروه NAFLD با SUPNAF (002/0P= و TRSUPNAF 017/0P= و بین گروه SHAM با SUPNAF 002/0P= و TRSUPNAF 015/0P=؛ همچنین بین گروه P و TRSUPNAF 013/0P= اختلاف معنیداری مشاهده شد (تصویر شماره 1).
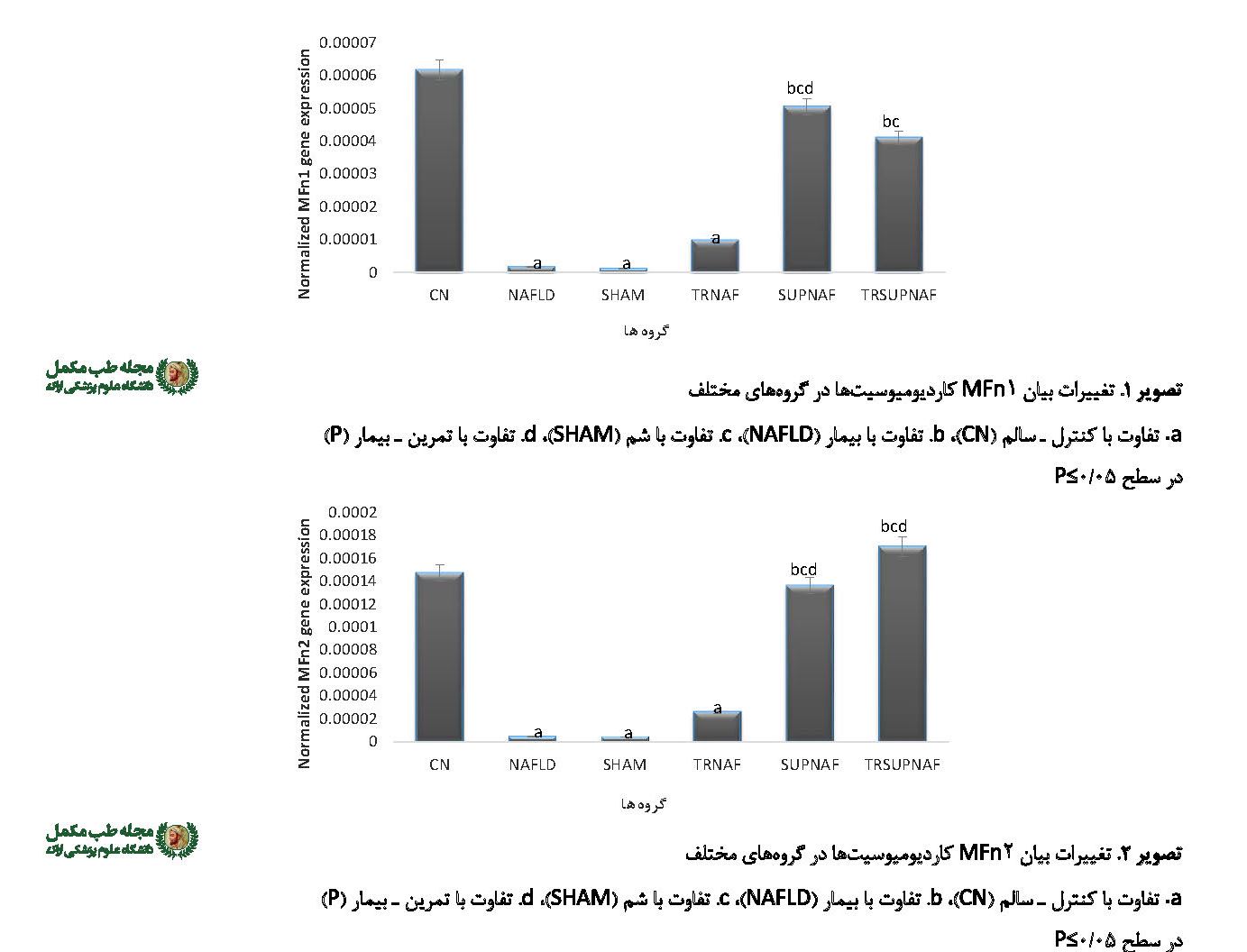
از دیگر نتایج پژوهش حاضر، تفاوت معنیدار در میزان تغییرات بیان MFn2 کاردیومیوسیتها بین گروههای مختلف وجود داشت (000/0P=، 482/27=F) (جدول شماره 3). نتایج آزمون تعقیبی توکی نشان داد بین گروههای CN با NAFLD (001/0P=)، SHAM (001/0P=) و P (001/0P=) تفاوت معنیداری وجود دارد. همچنین بین گروه NAFLD با SUPNAF (000/0P=) و TRSUPNAF (000/0P=)، گروه SHAM با SUPNAF (000/0P=) و TRSUPNAF (000/0P=) و بین گروه P با SUPNAF (000/0P=) و TRSUPNAF (000/0P=) اختلاف معنیداری مشاهده شد (تصویر شماره 2).
بحث
نتایج پژوهش حاضر نشان داد بیان MFn1 و MFn2 در گروه موشهای مبتلا به کبد چرب نسبت به گروه سالم کاهش معنیداری داشت. علت کاهش این شاخصها در بیماران NAFLD با گروه سالم ممکن است به دلیل عدم تعادل پروتئین همجوشی در گروه بیمار باشد. کاهش تعادل بین پروتئینهای همجوشی در بیماری کبد چرب به دلیل افزایش چربی بوده که موجب اختلال در عملکرد میتوکندری میشود [5, 6]. افزایش سنتز اسیدهای چرب کبدی، عامل مهمی در پاتوژنز کبد چرب به شمار میرود [24]. مطالعات، ارتباط قوی بین بیماری کبد چرب و بیماریهای قلبی را نشان دادهاند [25]. ROS بیش از حد ناشی از کبد چرب، منجر به تحریک آپوپتوز و نکروز قلبی میشود [26]. لیو و همکاران در پژوهشی روی موشهای صحرایی نر مدل کبد چرب گزارش کردند که میزان پروتئین MFn1، MFn2 کاهش مییابد [16]. گرینه و همکاران نیز در یک پژوهش که به بررسی رژیم غذایی پرچربی روی موشهای صحرایی نر پرداختند اعلام کردند که میزان پروتئین MFn1 و MFn2 کاهش مییابد [27].
در NAFLD اختلال در عملکرد میتوکندری باعث مهار MFn2 شده، در نتیجه تنفس میتوکندری میوسیتهای قلبی کاهش یافته و حساسیت به استرس اکسیداتیو افزایش مییابد [11]. ژائو و همکاران بیان کردند حذف MFn2 در قلب موشها باعث اختلال در متابولیسم چربی و کاهش تنفس میتوکندری میشود [28]. همچنین در پژوهشهای دیگر بیان شد که حذف MFn1 و MFn2 در قلب موشهای بزرگسال منجر به تکهتکهشدن میتوکندری، اختلال در تنفس میتوکندری و درنهایت منجر به کاردیوکیوپاتی کشنده میشود که اینها نشان میدهد میتوفیوژنها برای عملکرد طبیعی میتوکندری قلب ضروری هستند [28].
برخلاف یافتههای این پژوهش، جانگ و همکاران در پژوهشی روی موشهای صحرایی چاق تحت رژیم غذایی پرچربی نشان دادند میزان پروتئینهای همجوشی (MFn1، MFn2) بدون تغییر بود [29]. به نظر میرسد که کاهش پروتئینهای همجوشی در این پژوهش، در گروه بیمار نسبت به گروه سالم، به دلیل افزایش استرس اکسیداتیو است. افزایش اسیدهای چرب باعث تحریک متابولیسم شده و موجب افزایش استرس اکسیداتیو و التهاب میشود [8]. مطالعات اخیر نشان میدهد افزایش سطح اکسیداتیو ناشی از تولید بیش از حد رادیکالهای آزاد به عنوان یکی از مکانیسمهایی است که باعث افزایش مرگ سلولی شده و کاهش سطح آنتیاکسیدان سبب پیشرفت بیماری کبد چرب غیرالکلی میشود [30].
از دیگر نتایج پژوهش حاضر افزایش معنیدار بیان MFn1 وMFn2 در گروههای عصاره و تمرین ـ عصاره نسبت به گروه بیمار بود. با این حال، افزایش بیان MFn1 و MFn2 در گروه تمرین معنیدار نشد. افزایش میزان این پروتئینها در نتیجه فعالیتهای ورزشی طولانیمدت توسط چندین پژوهش نشان داده شد [32 ،31]. مک لینز و همکاران (2017) در پژوهشی گزارش کردند فعالیت ورزشی طولانیمدت باعث افزایش پروتئین MFn2 میشود [33]. کونپکا و همکاران نیز بیان کردند فعالیت ورزشی طولانیمدت باعث افزایش مقدار MFn1 میشود [34].
پویایی و مورفولوژی میتوکندری، به طور فزایندهای توسط گونههای فعال اکسیژن تنظیم میشود. -O2 توسط پراکسیددیسموتاز، به پراکسیدهیدروژن (H2O2) تبدیل میشود، که با فعالشدن NRF2 (عامل فاکتور رونویسی) منجر به افزایش همجوشی میشود [36 ،35]. علاوه بر این مسیر سیگنالینگ، ژن PGC-1α تنظیمکننده MFn1 و MFn2 است [37]. رونویسی MFn1 ،MFn2 توسط PGC-1α از طریق ERRα تنظیم میشود [38]. فعالیت ورزشی نقش مهمی در تنظیم همجوشی میتوکندری از مسیر استرساکسیداتیو دارد. فعالیت ورزشی منظم سبب کاهش شاخصهای التهابی و افزایش ظرفیت یا فعالیت آنتیاکسیدانی و کاهش استرس اکسیداتیو میشود [5].
کاهش غلظت شاخصهای استرس اکسیداتیو با افزایش بیان ژنهای MFn1 و MFn2 همراه است که باعث افزایش فعالیت همجوشی میتوکندری میشود [39]. با وجود این، برخی پژوهشها با نتایج این تحقیق همخوانی ندارد. فینگ [40] و واکلزما [41] بیان کردند که فعالیت ورزشی طولانیمدت باعث کاهش مقدار MFn2 میشود. مارتن و همکاران نیز نشان دادند فعالیت ورزشی طولانیمدت باعث کاهش پروتئین MFn2 در عضلات اسکلتی موشها میشود [42]. شاید تفاوت در نوع آزمودنیها، شدت، مدت و نوع بافت تشریحشده، علت تفاوت در نتیجه پژوهشهای بیانشده با تحقیق حاضر باشد.
یافتههای ما نشان میدهد تجویز رزوراترول در کنار تمرین ورزشی هوازی تأثیر درمانی بیشتری بر افزایش بیان MFn1 و MFn2 قلبی نسبت به تمرین بهتنهایی دارد. همچنین رزوراترول نیز باعث افزایش معنیدار در میزان بیان این پروتئینها نسبت به گروه بیمار شد. مطالعات مختلف نشان داد استفاده از رزوراترول با کاهش تولید ROS و کاهش بیان سایتوکاینهای التهابی و همچنین افزایش شاخصهای ضدالتهابی و بهبود وضعیت آنتیاکسیدانی همراه است [13]. در پژوهش حاضر نیز مصرف رزوراترول از طریق کاهش شاخصهای التهابی و استرس اکسیداتیو و همچنین افزایش عوامل آنتیاکسیدانی سبب بهبود بیماری NAFLD شد [23].
به نظر، رزوراترول با فعالکردن AMPK و فاکتورهای رونویسی میتوکندری، باعث ایجاد بیوژنز میتوکندری میشود [43]. به نظر میرسد انجام فعالیت ورزشی هوازی در کنار مصرف مکملهای آنتیاکسیدانی از جمله رزوراترول کمک زیادی در مهار تولید رادیکالهای آزاد و استرس اکسیداتیو در سلولهای بافت قلبی بیماران NAFLD دارد و از این طریق باعث افزایش بیان ژنهای همجوشی MFn1 و MFn2 میشود. از محدودیتهای پژوهش حاضر، اندازهگیری دیگر شاخصهای مربوط به پویایی میتوکندری بهویژه شاخصهای مربوط به شکاف میتوکندری بود که میتوانست درک بهتری از پویایی میتوکندری میوسیتهای قلبی ارائه دهد. از آنجایکه بیماری NAFLD به صورت درازمدت ثأثیرات خود را به جای میگذارد، شاید طول دوره پژوهش در تحقیق حاضر از محدودیتهای مهم دیگر برای بررسی دقیق اثرات تمرین ورزشی و مصرف رزوراترول بر این بیماری باشد. بنابراین توصیه میشود در پروتکلهای بعدی از دورههای طولانیتر استفاده شود.
نتیجهگیری
نتایج مطالعه حاضر نشان داد درمان ترکیبی تمرین ورزشی هوازی با رزوراترول، سبب افزایش بیان MFn1 و MFn2 بافت قلب موشهای صحرایی نر NAFLD شد. احتمالاً ترکیبی از تمرین هوازی و رزوراترول میتواند از طریق تغییر در بیان شاخصهای همجوشی میتوکندری، عوامل آپوپتوز ناشی از استرس اکسیداتیو را در بیماران NAFLD تعدیل کند.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این تحقیق با تأیید کمیته اخلاق در دانشگاه آزاد ساری و با کد R.IAU.SARI.REC.1397.8 انجام شد.
حامی مالی
این تحقیق در قالب رساله دکتری آقای حسن دلروز در دانشکده تربیتبدنی دانشگاه آزاد اسلامی واحد آیتاللّه آملی انجام شد.
مشارکت نویسندگان
مفهومسازی، روششناسی و اعتبارسنجی: احمد عبدی، حسن دلروز و پروین فرزانگی؛ تحقیق و بررسی منابع، نگارش پیشنویس: احمد عبدی، پروین فرزانگی، علیرضا براری و حسن دلروز؛ ویراستاری و نهاییسازی نوشته: احمد عبدی، حسن دلروز؛ نظارت و مدیریت پروژه: احمد عبدی، علیرضا براری، پروین فرزانگی.
تعارض منافع
در این پژوهش هیچگونه تضاد منافعی برای نویسندگان وجود ندارد.
تشکر و قدردانی
بدینوسیله، نویسندگان تشکر و قدردانی خود را از دانشگاه آزاد اسلامی واحد آیتاللّه آملی اعلام میدارند.
References
Wilkins T, Tadkod A, Hepburn I, Schade RR. Nonalcoholic fatty liver disease: Diagnosis and management. American Family Physician. 2013; 88(1):35-42.
Hardy T, McPherson S. NAFLD in Asia-clinical associations with advanced disease become clearer. Alimentary Pharmacology & Therapeutics. 2018; 47(7):1035-6. [DOI:10.1111/apt.14557] [PMID]
Henao-Mejia J, Elinav E, Jin CC, Hao L, Mehal WZ, Strowig T, et al. Inflammasome-mediated dysbiosis regulates progression of NAFLD and obesity. Nature. 2012; 482(7384):179-85. [DOI:10.1038/nature10809] [PMID] [PMCID]
Yu T, Wang L, Yoon Y. Morphological control of mitochondrial bioenergetics. Frontiers in Bioscience (Landmark Edition). 2015; 20:229-46. [DOI:10.2741/4306] [PMID]
Yan Z, Lira VA, Greene NP. Exercise training-induced regulation of mitochondrial quality. Exercise and Sport Sciences Reviews. 2012; 40(3):159-64. [DOI:10.1097/JES.0b013e3182575599] [PMID] [PMCID]
Ding H, Jiang N, Liu H, Liu X, Liu D, Zhao F, et al. Response of mitochondrial fusion and fission protein gene expression to exercise in rat skeletal muscle. Biochimica et Biophysica Acta (BBA) - General Subjects. 2010; 1800(3):250-6. [DOI:10.1016/j.bbagen.2009.08.007] [PMID]
Wai T, Langer T. Mitochondrial dynamics and metabolic regulation. Trends in Endocrinology & Metabolism. 2016; 27(2):105-17. [DOI:10.1016/j.tem.2015.12.001] [PMID]
Paradies G, Paradies V, Ruggiero FM, Petrosillo G. Oxidative stress, cardiolipin and mitochondrial dysfunction in nonalcoholic fatty liver disease. World Journal of Gastroenterology. 2014; 20(39):14205-18. [DOI:10.3748/wjg.v20.i39.14205] [PMID] [PMCID]
Caldwell SH, Swerdlow RH, Khan EM, Iezzoni JC, Hespenheide EE, Parks JK, et al. Mitochondrial abnormalities in non-alcoholic steatohepatitis. Journal of Hepatology. 1999; 31(3):430-4. [DOI:10.1016/S0168-8278(99)80033-6]
Caldwell SH, de Freitas LAR, Park SH, Moreno MLV, Redick JA, Davis CA, et al. Intramitochondrial crystalline inclusions in nonalcoholic steatohepatitis. Hepatology. 2009; 49(6):1888-95. [DOI:10.1002/hep.22851] [PMID]
Bach D, Pich S, Soriano FX, Vega N, Baumgartner B, Oriola J, et al. Mitofusin-2 determines mitochondrial network architecture and mitochondrial metabolism: A novel regulatory mechanism altered in obesity. Journal of Biological Chemistry. 2003; 278(19):17190-7. [DOI:10.1074/jbc.M212754200] [PMID]
Krieger DA, Tate CA, McMillin-Wood J, Booth FW. Populations of rat skeletal muscle mitochondria after exercise and immobilization. Journal of Applied Physiology. 1980; 48(1):23-8. [DOI:10.1152/jappl.1980.48.1.23] [PMID]
Wang H, Jiang T, Li W, Gao N, Zhang T. Resveratrol attenuates oxidative damage through activating mitophagy in an in vitro model of Alzheimer’s disease. Toxicology Letters. 2018; 282:100-8. [DOI:10.1016/j.toxlet.2017.10.021] [PMID]
El-Boghdady NA, Abdeltawab NF, Nooh MM. Resveratrol and montelukast alleviate paraquat-induced hepatic injury in mice: Modulation of oxidative stress, inflammation, and apoptosis. Oxidative Medicine and Cellular Longevity. 2017; 2017:9396425. [DOI:10.1155/2017/9396425] [PMID] [PMCID]
Wiciński M, Socha M, Walczak M, Wódkiewicz E, Malinowski B, Rewerski S, et al. Beneficial effects of resveratrol administration-focus on potential biochemical mechanisms in cardiovascular conditions. Nutrients. 2018; 10(11):1813. [DOI:10.3390/nu10111813] [PMID] [PMCID]
Liu R, Jin P, Yu L, Wang Y, Han L, Shi T, et al. Impaired mitochondrial dynamics and bioenergetics in diabetic skeletal muscle. PLoS One. 2014; 9(3):e92810. [DOI:10.1371/journal.pone.0092810] [PMID] [PMCID]
Legros F, Lombès A, Frachon P, Rojo M. Mitochondrial fusion in human cells is efficient, requires the inner membrane potential, and is mediated by mitofusins. Molecular Biology of the Cell. 2002; 13(12):4343-54. [DOI:10.1091/mbc.e02-06-0330] [PMID] [PMCID]
Archer SL. Mitochondrial dynamics-mitochondrial fission and fusion in human diseases. New England Journal of Medicine. 2013; 369(23):2236-51. [DOI:10.1056/NEJMra1215233] [PMID]
Das S, Alagappan VKT, Bagchi D, Sharma HS, Maulik N, Das DK. Coordinated induction of iNOS-VEGF-KDR-eNOS after resveratrol consumption: A potential mechanism for resveratrol preconditioning of the heart. Vascular Pharmacology. 2005; 42(5-6):281-9. [DOI:10.1016/j.vph.2005.02.013] [PMID]
Hernández-Alvarez MI, Sebastián D, Vives S, Ivanova S, Bartoccioni P, Kakimoto P, et al. Deficient endoplasmic reticulum-mitochondrial phosphatidylserine transfer causes liver disease. Cell. 2019; 177(4):881-95.E17. [DOI:10.1016/j.cell.2019.04.010] [PMID]
Efati M, Khorrami M, Zarei Mahmmodabadi A, Raouf Sarshoori J. [Induction of an animal model of non-alcoholic fatty liver disease using a formulated high-fat diet (Persian)]. Journal of Babol University of Medical Sciences. 2016; 18(11):57-62. [DOI:10.22088/jbums.18.11.57]
Batacan Jr RB, Duncan MJ, Dalbo VJ, Connolly KJ, Fenning AS. Light-intensity and high-intensity interval training improve cardiometabolic health in rats. Applied Physiology, Nutrition, and Metabolism. 2016; 41(9):945-52. [DOI:10.1139/apnm-2016-0037] [PMID]
Hajighasem A, Farzanegi P, Mazaheri Z. Effects of combined therapy with resveratrol, continuous and interval exercises on apoptosis, oxidative stress, and inflammatory biomarkers in the liver of old rats with non-alcoholic fatty liver disease. Archives of Physiology and Biochemistry. 2019; 125(2):142-9. [DOI:10.1080/13813455.2018.1441872] [PMID]
Pessayre D, Fromenty B. NASH: A mitochondrial disease. Journal of Hepatology. 2005; 42(6):928-40. [DOI:10.1016/j.jhep.2005.03.004] [PMID]
Alirol E, James D, Huber D, Marchetto A, Vergani L, Martinou JC, et al. The mitochondrial fission protein hFis1 requires the endoplasmic reticulum gateway to induce apoptosis. Molecular Biology of the Cell. 2006; 17(11):4593-605. [DOI:10.1091/mbc.e06-05-0377] [PMID] [PMCID]
Galloway CA, Lee H, Brookes PS, Yoon Y. Decreasing mitochondrial fission alleviates hepatic steatosis in a murine model of nonalcoholic fatty liver disease. American Journal of Physiology-Gastrointestinal and Liver Physiology. 2014; 307(6):G632-G41. [DOI:10.1152/ajpgi.00182.2014] [PMID] [PMCID]
Greene NP, Nilsson MI, Washington TA, Lee DE, Brown LA, Papineau AM, et al. Impaired exercise-induced mitochondrial biogenesis in the obese Zucker rat, despite PGC-1α induction, is due to compromised mitochondrial translation elongation. American Journal of Physiology-Endocrinology and Metabolism. 2014; 306(5):E503-E11. [DOI:10.1152/ajpendo.00671.2013] [PMID]
Hall A, Burke N, Dongworth R, Hausenloy D. Mitochondrial fusion and fission proteins: Novel therapeutic targets for combating cardiovascular disease. British Journal of Pharmacology. 2014; 171(8):1890-906. [DOI:10.1111/bph.12516] [PMID] [PMCID]
Jheng HF, Tsai PJ, Guo SM, Kuo LH, Chang CS, Su IJ, et al. Mitochondrial fission contributes to mitochondrial dysfunction and insulin resistance in skeletal muscle. Molecular and Cellular Biology. 2012; 32(2):309-19. [DOI:10.1128/MCB.05603-11] [PMID] [PMCID]
Chen L, Gong Q, Stice JP, Knowlton AA. Mitochondrial OPA1, apoptosis, and heart failure. Cardiovascular Research. 2009; 84(1):91-9. [DOI:10.1093/cvr/cvp181] [PMID] [PMCID]
Perry CGR, Lally J, Holloway GP, Heigenhauser GJF, Bonen A, Spriet LL. Repeated transient mRNA bursts precede increases in transcriptional and mitochondrial proteins during training in human skeletal muscle. The Journal of Physiology. 2010; 588(Pt 23):4795-810. [DOI:10.1113/jphysiol.2010.199448] [PMID] [PMCID]
Iqbal S, Hood DA. Oxidative stress-induced mitochondrial fragmentation and movement in skeletal muscle myoblasts. American Journal of Physiology-Cell Physiology. 2014; 306(12):C1176-C83. [DOI:10.1152/ajpcell.00017.2014] [PMID] [PMCID]
MacInnis MJ, Zacharewicz E, Martin BJ, Haikalis ME, Skelly LE, Tarnopolsky MA, et al. Superior mitochondrial adaptations in human skeletal muscle after interval compared to continuous single‐leg cycling matched for total work. The Journal of Physiology. 2017; 595(9):2955-68. [DOI:10.1113/JP272570] [PMID] [PMCID]
Konopka AR, Suer MK, Wolff CA, Harber MP. Markers of human skeletal muscle mitochondrial biogenesis and quality control: Effects of age and aerobic exercise training. The Journals of Gerontology Series A: Biomedical Sciences and Medical Sciences. 2014; 69(4):371-8. [DOI:10.1093/gerona/glt107] [PMID] [PMCID]
Powers SK, Talbert EE, Adhihetty PJ. Reactive oxygen and nitrogen species as intracellular signals in skeletal muscle. The Journal of Physiology. 2011; 589(9):2129-38. [DOI:10.1113/jphysiol.2010.201327] [PMID] [PMCID]
Sabouny R, Fraunberger E, Geoffrion M, Ng ACH, Baird SD, Screaton RA, et al. The Keap1-Nrf2 stress response pathway promotes mitochondrial hyperfusion through degradation of the mitochondrial fission protein Drp1. Antioxidants & Redox Signaling. 2017; 27(18):1447-59. [DOI:10.1089/ars.2016.6855] [PMID]
Liesa M, Borda-d’Água B, Medina-Gómez G, Lelliott CJ, Paz JC, Rojo M, et al. Mitochondrial fusion is increased by the nuclear coactivator PGC-1β. PLoS One. 2008; 3(10):e3613. [DOI:10.1371/journal.pone.0003613] [PMID] [PMCID]
Ikeda Y, Sciarretta S, Nagarajan N, Rubattu S, Volpe M, Frati G, et al. New insights into the role of mitochondrial dynamics and autophagy during oxidative stress and aging in the heart. Oxidative Medicine and Cellular Longevity. 2014; 2014:210934. [DOI:10.1155/2014/210934] [PMID] [PMCID]
Trewin AJ, Berry BJ, Wojtovich AP. Exercise and mitochondrial dynamics: Keeping in shape with ROS and AMPK. Antioxidants. 2018; 7(1):7. [DOI:10.3390/antiox7010007] [PMID] [PMCID]
Feng H, Kang C, Dickman JR, Koenig R, Awoyinka I, Zhang Y, et al. Training‐induced mitochondrial adaptation: Role of peroxisome proliferator‐activated receptor γ coactivator‐1α, nuclear factor‐κB and β‐blockade. Experimental Physiology. 2013; 98(3):784-95. [DOI:10.1113/expphysiol.2012.069286] [PMID]
Wyckelsma VL, Levinger I, McKenna MJ, Formosa LE, Ryan MT, Petersen AC, et al. Preservation of skeletal muscle mitochondrial content in older adults: Relationship between mitochondria, fibre type and high‐intensity exercise training. The Journal of Physiology. 2017; 595(11):3345-59. [DOI:10.1113/JP273950] [PMID] [PMCID]
Marton O, Koltai E, Takeda M, Koch LG, Britton SL, Davies KJA, et al. Mitochondrial biogenesis-associated factors underlie the magnitude of response to aerobic endurance training in rats. Pflügers Archiv: European Journal of Physiology. 2015; 467(4):779-88. [DOI:10.1007/s00424-014-1554-7] [PMID] [PMCID]
Hart N, Sarga L, Csende Z, Koltai E, Koch LG, Britton SL, et al. Resveratrol enhances exercise training responses in rats selectively bred for high running performance. Food and Chemical Toxicology. 2013; 61:53-9. [DOI:10.1016/j.fct.2013.01.051] [PMID] [PMCID]


 ، احمد عبدی*2
، احمد عبدی*2 

 ، علیرضا براری1
، علیرضا براری1 

 ، پروین فرزانگی3
، پروین فرزانگی3 


