BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
URL: http://cmja.arakmu.ac.ir/article-1-753-fa.html
2- گروه فیزیولوژی، دانشکده پزشکی، دانشگاه علوم پزشکی اراک، اراک ، ایران.
مقدمه
جنتامایسین یکی از آنتیبیوتیکهای آمینوگلیکوزیدی است که به علت طیف گسترده اثرات ضد باکتریایی، فعالیت سریع، پایداربودن ساختمان شیمیایی و ارزان بودن در درمان عفونتها، بهخصوص علیه باکتریهای گرم منفی همچنان استفاده میشود. سمیت کلیوی و سمیت شنوایی عوارض جانبی اصلی ناشی از مصرف جنتامایسین است [1]. مطالعات قبلی نشان دادهاند که این اثرات مربوط به تولید گونههای فعال اکسیژن (ROS ) میباشد. با اینکه مقدار زیادی از جنتامایسین در ادرار دفع میشود، اما قابلیت تجمع انتخابی این دارو در قشر کلیهها سبب آسیب به انواع مختلف سلولی میشود [2]. جنتامایسین با اتصال به فسفولیپیدهای آنیونی موجود در غشاء پلاسمایی سلولهای توبول نزدیک از طریق اندوسیتوز وارد سلول شده و سپس در اندامکهای سلولی ازجمله میتوکندریها و هسته سلول تجمع پیدا میکند [3]. هنگام سمیت کلیوی ناشی از جنتامایسین، گونههای فعال اکسیژن (ROS) تولیدشده با نکروز سلولهای اپیتلیال توبولی و آسیبهای گلومرولی و همچنین تأثیر بر عروق کلیه سبب انقباض سلولهای مزانژیال گلومرولی و افزایش مقاومت عروق کلیه، کاهش قابلتوجه جریان خون کلیه و فیلتراسیون گلومرولی میشود [1].
استفاده از گیاهان دارویی و عصارههای گیاهی و مکملها با توجه به خواص و ترکیبات مؤثر آنها در درمان تعداد بسیاری از بیماریها در سطح وسیعی متداول است [4]. گیاه مرزنجوش با نام علمی Origanum vulgare از خانواده نعناییان ازجمله گیاهان دارویی است که برگها و بهخصوص سرشاخههای گلدار این گیاه مصرف دارویی دارند. تاکنون ترکیبات فعال دارویی در این گیاه شناسایی و استخراج شدهاند که میتوان فلاونوئیدها، تاننها، گلیکوزیدها، استرولها، ویتامینها و ترکیبات ترپنوئیدی را نام برد [5]. ازجمله مهمترین این ترکیبات، سینالول، سنیئول، تیمول، کارواکرول، میرسن، کاریوفیلن، تانن، صمغ، اسانس روغن فرار، گلوکوزید، سابونوزید و رزانیل استات است [5، 6]. در طب سنتی، مرزنجوش به عنوان دارویی ضدنفخ، مدر، معرق، قاعدهآور، خلطآور و ضدعفونیکننده کاربرد دارد [5]. تحقیقات قبلی نشان داده است که مواد مؤثر مرزنجوش علاوه بر داشتن خواص ضدباکتریایی، ضدقارچی و ضدویروسی، اثرات بازدارندگی رشد سلولهای سرطانی سینه و سلولهای سرطانی کلون انسان را دارد [7]. در یک مطالعه دیگر، بخور عصاره مرزنجوش سبب بهبود رینوسینوزیت مزمن و کاهش علائم آن مانند سردرد، احتقان بینی، درد سینوس، درد دور چشم، وجود چرک در بینی و سرفه شد. نتایج مطالعات قبلی نشان داده است که عصاره مرزنجوش اثرات ضد التهابی دارد و ترکیبات سابینن هیدرات، کارواکرول و تیمول موجود در عصاره مرزنجوش میتواند با کاهش سنتز سیتوکینهای پیشالتهابی IL- 6 و IL-1β، TNF-α و همچنین افزایش سطح سیتوکینهای ضدالتهابی 10-IL سبب جلوگیری از التهاب مزمن بیماریهای قلب شود [9، 8]. لوپز و همکاران نشان دادند که ترپنهایی نظیر کارواکرول استات و تیمول موجود در اسانس مرزنجوش، کاهش معناداری در سطح ROS و اکسید نیتروژن به وجود میآورند [10].
مطالعات قبلی، اثرات کاهشدهنده قند خون و کنترل دیابت، کاهش فشار خون و همچنین جلوگیری از بیماریهای قلبی-عروقی عصاره مرزنجوش را نشان دادهاند [11]. مطالعات فارماکولوژیکی نشان داده است که پتانسیل بالای آنتیاکسیدانی مرزنجوش به دلیل وجود مونوترپنهای فنولی نظیر تیمول، کارواکرول و برخی دیگر از ترکیبات فنولی مانند اریگانوزاید و رزمارینیک اسید است که پتانسیل بالایی در جلوگیری از آسیبهای اکسیداتیو دارند [12].
ترکیبات عصاره مرزنجوش غنی از پلیفنولها خصوصاً فلاونوئیدها و اسیدهای فنولی است و نشان داده شده که ترکیبات فنولی دارای اثرات محافظتکنندگی در برابر گونههای فعال اکسیژن است و نیز سیستم آنتیاکسیدان بدن را تقویت میکند [15-13].
در مطالعه قبلی ما، اثر مؤثر پس درمان با عصاره اتانولی مرزنجوش روی آسیب حاد کلیوی ناشی از جنتامایسین مشخص شد [16]. در این مطالعه با توجه به خاصیت آنتیاکسیدانی عصاره اتانولی مرزنجوش، اثر درمان همزمان عصاره روی سمیت کلیوی جنتامایسین بررسی شد. در صورت اثبات اثرات محفاظتی گیاه مرزنجوش میتوان با انجام تحقیقات بیشتر در بیمارانی که مجبور به استفاده از جنتامایسین در دوزهای بالا و طولانیمدت هستند، استفاده همزمان با مقدار مشخص از گیاه مرزنجوش برای پیشگیری از عوارض سمیت کلیوی ناشی از جنتامایسین را توصیه کرد.
مواد و روشها
این مطالعه تجربی روی 32 سر موش صحرایی سفید نر بالغ از نژاد ویستار، در محدوده وزنی 250-200 گرم انجام شد. موشها با دسترستی آزاد به آب و غذای کافی و در شرایط کنترلشده از نظر میزان روشنایی (با چرخه 12 ساعت روشنایی و 12 ساعت تاریکی) و دمای ثابت محیط (C°23±2)نگه داری شدند [16]. در این مطالعه حیوانات به چهار گروه و هر گروه شامل 8 سر موش صحرایی تقسیم شدند.
2- گروه با سمیت کلیوی: به حیوانات این گروه به مدت 8 روز متوالی،100 میلیگرم بر کیلوگرم جنتامایسین (البرز دارو- ایران) به صورت داخل صفاقی تزریق شد.
3- گروه درمان همزمان با حامل جنتامایسین و عصاره اتانولی گیاه مرزنجوش: حیوانات این گروه به مدت 8 روز متوالی روزانه 0/5 میلیلیتر نرمال سالین به صورت داخل صفاقی و گاواژ همزمان عصاره اتانولی گیاه مرزنجوش (40 میلیگرم بر کیلوگرم) دریافت کردند.
4- گروه سمیت کلیوی و درمان همزمان با عصاره اتانولی گیاه مرزنجوش: حیوانات این گروه به مدت 8 روز متوالی 100میلیگرم بر کیلوگرم جنتامایسین (البرز دارو- ایران) به صورت داخل صفاقی و گاواژ همزمان عصاره اتانولی گیاه مرزنجوش (40 میلیگرم بر کیلوگرم ) دریافت کردند.
به منظور جمعآوری ادرار، موشها در روز نهم به مدت 12 ساعت به درون قفس متابولیک منتقل شدند که در این مدت به آب و غذا دسترسی داشتند. پس از جمعآوری ادرار هر کدام از موشها با تزریق پنتوباربیتال سدیم (60-50 میلیگرم بر کیلوگرم: سیگما-امریکا) بیهوش شده و میزان فشار خون آنها با استفاده از شریان دمی با استفاده از دستگاه Power Lab (استرالیاAD Instruments-) اندازهگیری شد [15].
پس از بیهوش کردن و باز کردن شکم حیوانات با استفاده از سرنگ هپارینه، 2 میلیلیتر خون از آئورت شکمی گرفته شد. برای جدا کردن پلاسما، خون گرفتهشده به مدت 15 دقیقه با سرعت rpm 3000 سانترفیوژ (AG22331 Eppendorf- آلمان)گردید. برای ارزیابی میزان آسیب کلیوی، مقادیر کراتینین و نیتروژن اوره خون [BUN] و غلظت سدیم [+Na] و پتاسیم [+K] همچنین اسمولالیته در نمونههای پلاسما و ادرار اندازهگیری شد. با استفاده از مقادیر اندازهگیریشده در آزمایشگاه، میزان کلیرانس کراتینین (CCr) و همچنین مقادیر دفع مطلق سدیم (UNaVº) و پتاسیم ( UKVº)، دفع نسبی سدیم (FENa ) و پتاسیم (FEK) با استفاده از روابط زیر محاسبه شد [17].

برای تعیین میزان آسیب بافتی پس ازخونگیری، کلیه چپ جدا شده و پس از جدا کردن، کپسول به دو قسمت مساوی تقسیم شد و برای فیکس کردن، در محلول در فرمالین 10 درصد قرار گرفت و به آزمایشگاه پاتولوژی ارسال شد. کلیه راست برای آزمایشهای MDA و FRAP ابتدا در نیتروژن مایع و سپس به فریزر منفی بیست درجه سانتیگراد منتقل شد.
روش عصارهگیری اتانولی مرزنجوش
پس از تعیین و تأیید تاکسونومی برگهای جمعآوریشده گیاه مرزنجوش توسط کارشناس متخصص گیاهشناسی دانشگاه اراک، برگها درسایه خشک و سپس 1000 گرم از برگهای خشکشده آسیاب شد. 500 گرم از پودر آسیابشده به ارلن محتویپ 2/5 لیتر اتانول اضافه شد و به مدت 72 ساعت با همزن مخلوط گردید. با استفاده از کاغذ صافی شماره 2 واتمن (Whatman) مخلوط حاصله دو بار صاف شد. سپس در دستگاه روتاری (ویجنز آلمان-rotary evaporator) در دمای 60 درجه قرار گرفت. به منظور تبخیر اتانول، عصاره به مدت 24 ساعت در انکوباتور در دمای 60 درجه قرار گرفت، سپس عصاره خشک گیاه در آب مقطر حل شد. با توجه به تحقیفات قبلی، مقدار 40 میلیگرم بر کیلوگرم به موشها گاواژ شد [18، 15].
آزمایش FRAP
با استفاده از روش بنزی و همکاران، ظرفیت آنتیاکسیدانی نمونهها اندازهگیری شد. Fe3+ در حضور مواد آنتیاکسیدان احیا شده و با TPTZ کمپلکس آبی رنگ Fe2+-TPTZ تولید میشود. غلظت ماده آنتیاکسیدان با میزان رنگ آبی تولیدشده متناسب است. میزان جذب نوری آن در طول موج nm 593 اندازهگیری شد.
پس از هموژنیزه کردن بافت کلیه در محلول بافر فسفاتی، میزان 50 میکرولیتر از بافت هموژنیزه شده کلیه به 1/5میلیلیتر از معرف FRAP اضافه گردید. معرف FRAP با مخلوط کردن 100 میلیلیتر بافراستات، 10 میلیلیتر محلول کلرید فریک، 10 میلیلیتر محلول TPTZ و 12 میلیلیتر آب مقطر تهیه شد. با استفاده از دستگاه اسپکتروفتومتر (UV 7500- SpectroLab –انگلیس) مقدار جذب نوری در طول موج 593 نانومتر در برابر شاهد آن اندازهگیری شد [11]. اندازهگیری مقدار مالون دی آلدئید از طریق واکنش یک مولکول آن با دو مولکو ل تیوباربیتوریک و ایجاد یک ترکیب صورتی رنگ انجام میشود که جذب نوری آن در طول موج 532 نانومتر اندازهگیری میشود [19].
آزمایش مالون دی آلدئید (MDA)
جنتامایسین با افزایش استرس اکسیداتیو و تولید رادیکالهای آزاد سبب پراکسیداسیون لیپیدی در نتیجه مالون دی آلدئید (MDA) در بافت کلیه میشود. برای اندازهگیری مالون دی آلدئید (MDA) مقدار 200میکرولیتر از بافت هموژنیزه شده کلیه به 1500 میکرولیتر از محلول اسید استیک 20 درصد، 1500 میکرولیتر از محلول تیو باربیتوریک ( TBA) 0/8 درصد و 200 میکرولیتر از محلول SDS 8/1 درصد اضافه شد؛ سپس با اضافه کردن آب مقطر، حجم آن به 4 میلیلیتر رسانده شد. نمونهها به مدت 60 دقیقه در حمام آبی 95 درجه سانتیگراد قرار گرفت. سپس به مدت 10 دقیقه نمونهها در یخ نگهداری شد. پس از سرد شدن نمونهها مقدار 4 میلیلیتر n - بوتانل به هر نمونه اضافه شد. به مدت 10 دقیقه نمونهها در دور rpm4000 سانتریفیوژ (فرانسه-3.11 Jouan-B) شد. با استفاده از اسپکتروفتومتر (UV 7500- SpectroLab انگلیس) جذب نوری فاز رویی صورتی رنگ در nm532 اندازهگیری شد [20].
مطالعه هیستو پاتولوژیک
کلیه چپ جداشده پس از فیکس شدن و طی کردن مراحل مشخص پاساژ بافتی شامل آبگیری و آغشتگی با پارافین، قالبگیری پارافینی از بافت کلیه تهیه شد. هنگام برشگیری، برشهای 5 میکرونی با استفاده از میکروتوم تهیه و سپس رنگآمیزی با استفاده از هماتوکسیلین و ائوزین انجام شد. میزان آسیب بافتی را متخصص آسیبشناسی ارزیابی کرد. در دو بخش گلومرولی و توبولی، تغییرات بافتی و میزان آسیب در بین گروهها با هم مقایسه شد. در بخش گلومرولی، تغییرات ایجادشده در فضای کپسول بومن، تعداد گلبولهای قرمز در گلومرول و درصد آسیب گلومرولی ارزیابی شد. در بخش لولهای، ریزش سلولهای اپی تلیالی لولهای به داخل لومن، ایجاد قالبهای پروتئینی در داخل لومن، واکوئلدار شدن سلولهای لولهای، نکروز سلولهای لولهای و درصد کل آسیب لولهای سنجیده شد. متخصص پاتولوژی بر اساس میزان درصد آسیب تشخیص دادهشده، درجهبندی را انجام داد؛ به این شکل که آسیب درجه صفر در صورت عدم ایجاد آسیب، آسیب درجه 1 (بین 1تا 25 درصد آسیب)، آسیب درجه 2 (بین 25 تا 50 درصد آسیب)، آسیب درجه 3 (بین 50 تا 75 درصد آسیب و آسیب درجه 4 (بین 75 تا100درصد نامیده شد [21، 17].
آنالیز آماری
دادهها به صورت میانگین±خطای استاندارد شده از میانگین (Mean±SEM) نشان داده شد. آنالیز آماری با استفاده از نرمافزار آماری SPSS نسخه 21 انجام شد. آنالیز واریانس یکطرفه (ANOVA) و به دنبال آن تست Tukey انجام شد. برای آنالیز نتایج بافتشناسی از آزمونهای غیر پارامتری Kruskal Wallis و Dunnett استفاده شد. در تمامی موارد در مقایسه گروهها سطح معنیدار با 0/05≥P در نظر گرفته شد.
در طول انجام تمام آزمایشها، تمام کدهای اخلاقی مورد تأیید کمیته نظارت بر حیوانات آزمایشگاهی دانشگاه علوم پزشکی اراک رعایت شد. کمیته اخلاق پژوهشی دانشگاه علوم پزشکی اراک انجام این مطالعه را باکد اخلاق IR.ARAKMU.REC 1394.284 به تصویب رساند.
یافتهها
اثر درمان همزمان با عصاره اتانولی مرزنجوش بر فشار خون سیستولی
در این مطالعه، اختلاف معنیداری بین مقادیر فشار خون سیستولی گروه سمیت کلیوی در مقایسه با سایر گروهها دیده نشد.
تأثیر درمان همزمان با عصاره اتانولی مرزنجوش بر مقادیر پلاسمایی:کراتینین (Cr)، نیتروژن اوره خونBUN)P ).
با انجام آنالیز واریانس یکطرفه ANOVA )) و به دنبال آن تست توکی مشخص شد که جنتامایسین، غلظت کراتینین پلاسما (0/13±2/91 میلیگرم در دسیلیتر) را در گروه سمیت کلیوی نسبت به گروه کنترل (0/02±0/55 میلیگرم در دسیلیتر) به شکل معنیداری افزایش داد (0/001>P). غلظت کراتینین پلاسما درگروه دریافتکننده جنتامایسین تحت درمان همزمان با عصاره اتانولی مرزنجوش (0/04±0/63 میلیگرم در دسیلیتر) در مقایسه با گروه سمیت کلیوی به صورت معنیدارکاهش داشت (0/001>P) (جدول شماره 1).
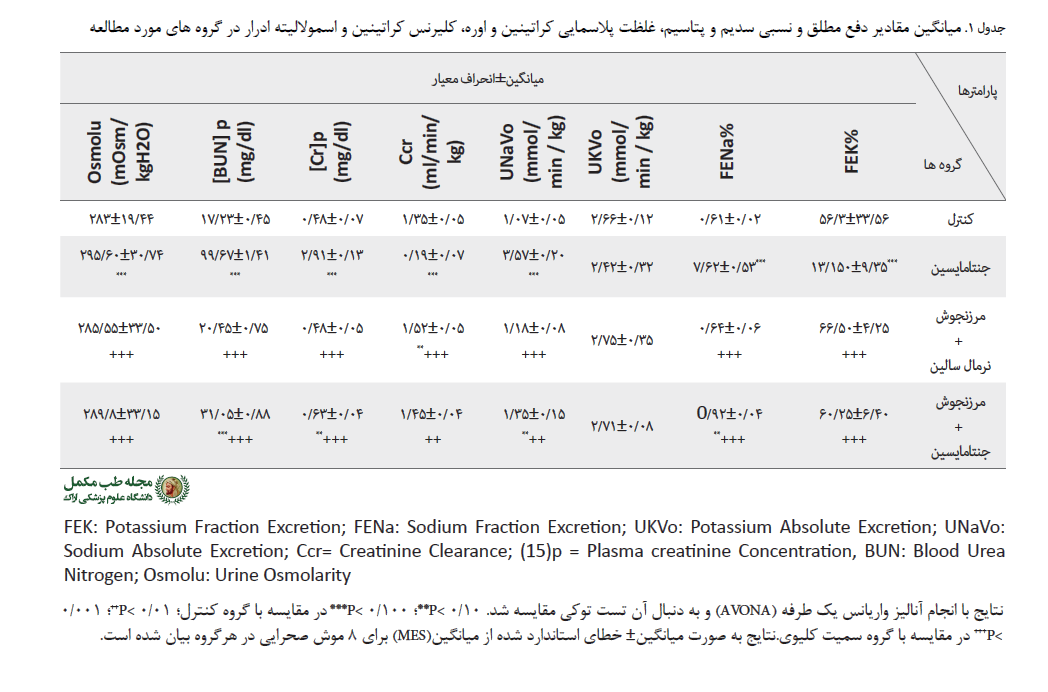
در موشهای دریافتکننده جنتامایسین، غلظت BUN پلاسما (1/41±99/67 میلیگرم در دسیلیتر) را در مقایسه با گروه کنترل (0/96±22/35 میلیگرم در دسیلیتر) به صورت معنیداری افزایش داد (0/001>P). در موشهای دریافتکننده جنتامایسین تحت درمان همزمان با عصاره اتانولی مرزنجوش غلظت BUN پلاسما (0/88±059/ 31 میلیگرم در دسیلیتر) نسبت به گروه جنتامایسین، کاهش معنیداری را نشان داد(0/001>P) (جدول شماره 1).
تأثیر درمان همزمان با عصاره اتانولی مرزنجوش بر کلیرانس کراتینین (Ccr)، دفع مطلق (˚UNaV) و نسبی (FENa) سدیم و دفع مطلق (UKV˚) و نسبی(FEK) پتاسیمکاهش معنیدار کلیرانس کراتینین در گروه سمیت کلیوی (0/07±0/19 میلیلیتردر دقیقه بر کیلوگرم) در مقایسه با گروه کنترل (0/05±1/35 میلیلیتر در دقیقه بر کیلوگرم) با انجام آنالیز واریانس یکطرفه (ANOVA) و به دنبال آن تست توکی مشاهده شد. افزایش معنیداری در کلیرانس کراتینین در موشهای دریافتکننده جنتامایسین تحت درمان همزمان با عصاره اتانولی مرزنجوش (0/04±1/45 میلیلیتردر دقیقه بر کیلوگرم) نسبت به گروه سمیت کلیوی مشاهده شد ( 0/001>P) (جدول شماره 1).
با انجام آنالیز واریانس یک طرفه (ANOVA) و به دنبال آن تست توکی مشخص شد که دفع نسبی سدیم در موشهای دریافتکننده جنتامایسین ( mmol/min/kg 0/53±7/62) افزایش معنیداری نسبت به موشهای گروه کنترل ( mmol/ min/kg 0/02±0/61) نشان داد (0/001>P). دفع نسبی سدیم در موشهای دریافتکننده جنتامایسین تحت درمان همزمان با عصاره اتانولی مرزنجوش (mmol/min/kg 0/04±0/92) به صورت معنیداری نسبت به گروه با سمیت کلیوی (mmol/min/kg 0/53± 7/62) کاهش یافت (0/001>P) (جدول شماره 1).
دفع نسبی پتاسیم در موشهای دریافتکننده جنتامایسین (mmol/min/kg 9/35±150/13) افزایش معنیداری را نسبت به گروه کنترل (3/56±56/33) نشان داد (0/001>P). دفع نسبی پتاسیم در موشهای دریافتکننده جنتامایسین تحت درمان با عصاره اتانولی مرزنجوش (6/40±60/25) کاهش معنیدار در مقایسه با گروه جنتامایسین نشان داد (0/001>P) (جدول شماره 1).
دفع مطلق سدیم در موشهای گروه با سمیت کلیوی (mmol/min/kg 0/20±3/57) افزایش معنیداری را در مقایسه با موشهای گروه کنترل(mmol/min/kg 0/05±1/07 میلیمول در دقیقه بر کیلوگرم) نشان داد (0/001>P ). دفع مطلق سدیم در موشهای دریافتکننده جنتامایسین تحت درمان همزمان با عصاره اتانولی مرزنجوش (mol/min/kg 0/15±1/35) کاهش معنیدار را در مقایسه با گروه با سمیت کلیوی نشان داد(0/001>P). اختلاف معنیداری در دفع مطلق پتاسیم در بین گروه های مشاهده نشد (جدول شماره 1).
تأثیر درمان همزمان با عصاره اتانولی مرزنجوش بر دفع ادراری سدیم، پتاسیم، کراتینین، اوره و اسمولالیته ادرار با انجام آنالیز واریانس یکطرفه (ANOVA) و با تست توکی مشخص شد که در گروه با سمیت کلیوی، جنتامایسین دفع ادراری سدیم (3/3±74/8 میکرو مول بر میلیلیتر) نسبت به گروه کنترل (0/9±55/4 میکرو مول برمیلیلیتر) افزایش معنیداری را نشان داد (0/001>P). در موشهای دریافتکننده جنتامایسین تحت درمان همزمان با عصاره اتانولی مرزنجوش دفع ادراری سدیم (2/4±59/5 میکرو مول برمیلیلیتر) کاهش معنیداری را نسبت به گروه با سمیت کلیوی جنتامایسین داشت (0/001>P) (جدول شماره1).
در گروه با سمیت کلیوی، جنتامایسین دفع ادراری پتاسیم (8/5±202/5 میکرو مول برمیلیلیتر) را به طور معنیداری نسبت به گروه کنترل (8/4±110/7 مول برمیلیلیتر) افزایش داد (0/001>P). درمان همزمان با عصاره اتانولی مرزنجوش در موشهای دریافتکننده جنتامایسین دفع ادراری پتاسیم (8/5±115/4 میکرو مول بر میلیلیتر) را به صورت معنیدار در مقایسه با گروه با سمیت کلیوی کاهش داد (0/001>P) (جدول شماره1).
در موشهای با سمیت کلیوی، جنتامایسین دفع ادراری کراتینین (0/8±24/5 میلیگرم در دسیلیتر) را به صورت معنیداری نسبت به گروه کنترل (0/9±48/5میلیگرم در دسیلیتر) کاهش داد (0/001>P). در موشهای دریافتکننده جنتامایسین تحت درمان همزمان با عصاره اتانولی مرزنجوش غلظت کراتینین ادرار (0/8±12/5 میلیگرم در دسیلیتر) در مقایسه با موشهای دریافتکننده جنتامایسین به طور معنیداری کاهش داد (0/001>P).
در موشهای با سمیت کلیوی، جنتامایسین دفع ادراری اوره (5/5±88/6 میلیگرم در دسیلیتر) را نسبت به گروه کنترل (5/7±5/120 میلیگرم در دسیلیتر) به صورت معنیداری کاهش داد (0/001>P). در موشهای دریافتکننده جنتامایسین تحت درمان همزمان با عصاره اتانولی مرزنجوش دفع ادراری اوره (8/4±43/ 6میلیگرم در دسیلیتر) نسبت به گروه با سمیت کلیوی به طور معنیدار کاهش داد (0/05>P) (جدول شماره1).
در موشهای با سمیت کلیوی، جنتامایسین اسمولالیته ادرار (18±724 میلی اسمول بر کیلوگرم آب) را در مقایسه با گروه کنترل (38/5±1480 میلی اسمول بر کیلوگرم آب) به شکل معنیداری کاهش داد (0/001>P). در موشهای دریافتکننده جنتامایسین تحت درمان همزمان با عصاره اتانولی مرزنجوش اسمولالیته ادرار (18/5±1245 میلی اسمول بر کیلوگرم آب) در مقایسه با گروه سمیت کلیوی جنتامایسین به صورت معنیدار افزایش داد (0/001>P).
غلظت سدیم، پتاسیم و اسمولالیته پلاسما در گروه سمیت کلیوی در مقایسه با سایر گروهها اختلاف معنیداری نداشت.
اثرات درمان همزمان با عصاره اتانولی مرزنجوش بر میزان FRAP و MDA بافت کلیه
با انجام تست توکی در آنالیز واریانس یکطرفه (ANOVA) مشخص شد که میزان FRAP بافت کلیه در موشهای صحرایی دریافتکننده جنتامایسین در مقایسه با گروه کنترل به طور معنیداری کاهش یافت (0/001>P). درمان همزمان با عصاره اتانولی مرزنجوش میزان FRAP در بافت کلیه را نسبت به گروه سمیت کلیوی با جنتامایسین به صورت معنیداری افزایش داد (0/001>P). در موشهای صحرایی دریافتکننده جنتامایسین میزان پراکسیداسیون لیپیدی (MDA) در بافت کلیه در مقایسه با گروه کنترل افزایش معنیداری داشت (0/001>P). درمان همزمان به مدت 8 روز با عصاره اتانولی مرزنجوش سبب کاهش معنیداری در میزان پراکسیداسیون لیپیدی (MDA) در بافت کلیه نسبت به گروه سمیت کلیوی با جنتامایسین شد (0/001>P) (تصویر شماره 2).

اثرات درمان همزمان عصاره اتانولی مرزنجوش بر هیستوپاتولوژی بافت کلیه
مقایسه نتایج بافتشناسی با استفاده از آزمونهای غیر پارامتری Kruskal Wallis و Dunnett انجام شد. مقایسه بافت کلیه گروه سمیت کلیوی با گروه کنترل نشاندهنده ایجاد آسیب شدید بافت کلیه توسط جنتامایسین بود. در مقایسه با موشهای سالم گروه کنترل (0grade)، مهمترین آسیبهای مشاهدهشده ایجاد نکروز در سلولهای توبولی (0/001>; P4grade)، افزایش فضای کپسول بومن (0/001>; P3grade)، واکوئلدار شدن (0/001>; P3grade) (P<0/01) و نیز ایجاد قالبهای پروتئینی (0/001>; P3grade)، کاهش تعداد گلبولهای قرمز در گلومرولها (0/001>; P3grade) و ریزش سلولها به داخل لومن توبول (0/001>; P3grade) بود. درمان همزمان با عصاره اتانولی مرزنجوش در موشهای دریافتکننده جنتامایسین نشاندهنده ایجاد یک اثر محافظتی و ایجاد آسیب کمتر در بافت کلیهها بود . درمان همزمان با عصاره اتانولی مرزنجوش به صورت معنیداری سبب کاهش نکروز سلولهای توبولی (0/001>; P2grade)، واکوئلدار شدن (0/001>; P2grade)، ایجاد قالبهای پروتئینی (0/001>; P1grade) و ریزش سلولها به داخل لومن توبول (0/001>; P1grade) و افزایش فضای کپسول بومن (0/001>; P1grade) و تعداد گلبولهای قرمز در گلومرولها (0/001>; P1grade) نسبت به گروه با سمیت کلیوی شد (جدول شماره 2و تصویر شماره 2).
.png)
.png)
بحث
در این مطالعه، تجویز همزمان عصاره اتانولی مرزنجوش به صورت خوراکی با جنتامایسین سبب پیشگیری از ایجاد اثرات سمیت کلیوی جنتامایسین شد. جنتامایسین، غلطت پلاسمایی کراتینین و اوره را افزایش داد و با کاهش کلیرنس باعث کاهش میزان دفع ادراری آنها شد. همانند نتایج مطالعات قبلی، تغییر در این مارکرها ازجمله کراتینین پلاسما و BUN نشاندهنده اختلال در عملکرد کلیه و ایجاد سمیت کلیوی توسط جنتامایسین میباشد. در توبول نزدیک تجمع جنتامایسین در سلولهای توبولی سبب آسیب به این قطعه شده و با نکروز سلولهای توبولی و ریزش سلولهای توبولی سبب اختلال در عملکرد کلیه میشود. جنتامایسین با کاهش جریان خون کلیه و همچنین انقباض سلولهای مزانژیال گلومرولی، میزان فیلتراسیون گلومرولی را کاهش داده و درنتیجه غلظت کراتینین و BUN پلاسما افزایش مییابد [22]. همانگونه که در این مطالعه مشاهده شد، پارامترهای استرس اکسیداتیو و عملکرد دفعی کلیهها در گروههای کنترل و دریافتکننده جنتامایسین اختلاف معنیداری با یکدیگر داشتند. مطالعات قبلی نشان داده است که جنتامایسین با افزایش تولید رادیکالهای آزاد ازجمله گونههای فعال اکسیژن، آنیونهای سوپراکسید، پراکسید هیدروژن سبب ایجاد استرس اکسیداتیو و افزایش پراکسیداسیون لیپیدی سبب آسیب و مرگ سلولی میشود [24، 23].
مطالعات قبلی، پتانسیل بالای آنتیاکسیدانی عصاره برگ گیاه مرزنجوش را نشان دادهاند که به دلیل وجود ترکیبات با خواص آنتیاکسیدانی قوی فنولی نظیر تیمول، کارواکرول و برخی دیگر از ترکیبات فنولی مانند اریگانوزاید و رزمارینیک اسید است که میتواند عوامل اکسیداتیو را از بین ببرد [25، 10]. ارتباط مستقیم بین ترکیبات فنولی و میزان فعالیت آنتیاکسیدانی در بسیاری از گونههای گیاهی در مطالعات قبلی نشان داده شده است. نتایج مطالعات قبلی نشان داده که ترکیبات فنولی میتوانند با خنثی کردن رادیکالهای آزاد حاصل از جنتامایسین، سبب کاهش سطح پلاسمایی کراتینین و اوره گردد. عصاره اتانولی مرزنجوش هم به دلیل داشتن ترکیبات فنولی میتواند در درمان همزمان از طریق کاهش دادن رادیکالهای آزاد روی ایجاد سمیت کلیوی توسط جنتامایسین تأثیر گذارد [27، 26].
نتایج این مطالعه همانند مطالعات قبلی نشان داد که جنتامایسین باعث افزایش دفع ادراری سدیم و پتاسیم میشود [28]. نتایج مطالعات قبلی نشان دادند که جنتامایسین با ایجاد استرس اکسیداتیو با مهار پمپهای سدیم-پتاسیم (Na+/K+- ATPase) و همچنین مهار کانالهای سدیمی میتواند سبب افزایش دفع ادراری سدیم و پتاسیم شود [19]. جنتامایسین با مهار تولید ATP و پمپ الکتروژنیک سدیم-پتاسیم سبب ایجاد تورم سلولی و نکروز سلولهای توبول میشود [30، 29]. در این مطالعه نشان داده شدکه ترکیبات آنتیاکسیدانی موجود در عصاره اتانولی مرزنجوش میتواند با کاهش رادیکالهای آزاد و استرس اکسیداتیو سبب کاهش دفع سدیم و پتاسیم در ادرار شود [31].
جنتامایسین با تولید ROS سبب انقباض سلولهای مزانژیال گلومرولی و افزایش تولید تنگکنندههای عروقی میشود و با انقباض گلومرول، تعداد گلبولهای قرمز موجود در گلومرول را کاهش میدهد که این تغییرات در مطالعات بافتی مشخص شد [1]. ترکیبات پلی فنولی عصاره اتانولی مرزنجوش با دارا بودن خاصیت آنتیاکسیدانی قوی سبب حفظ همو دینامیک کلیه در هنگام ایجاد سمیت کلیوی جنتامایسین میشود [32].
همانند یافتههای قبلی، نتایج این مطالعه نشان داد که جنتامایسین با ایجاد گونههای فعال اکسیژن و استرس اکسیداتیو سبب نکروز سلولهای توبولی، ریزش سلولهای توبولی، تشکیل قالبهای پروتئینی در داخل لومن، واکوئلدار شدن سلولهای توبولی، کاهش تعداد گلبولهای قرمز در کلافه گلومرولی و افزایش فضای کپسول بومن سبب سمیت کلیوی و اختلال در عملکرد کلیه میشود [33 ،16 ،1]. در این مطالعه، درمان همزمان با عصاره اتانولی گیاه مرزنجوش در موشهای دریافتکننده جنتامایسین از ایجاد آسیب بافتی جلوگیری کرد. ترکیبات فنولی عصاره اتانولی مرزنجوش با داشتن گروه هیدروکسیل و همچنین خاصیت احیاکنندگی، توانایی به داماندازی رادیکالهای آزاد را دارند. همچنین درمان همزمان با عصاره اتانولی گیاه مرزنجوش در موشهای دریافتکننده جنتامایسین سبب کاهش میزان مالون دی آلدئید (MDA) بافت کلیه و افزایش میزان FRAPشد. همانند مطالعات قبلی، درمان همزمان با عصاره اتانولی گیاه مرزنجوش با کاهش استرس اکسیداتیو میتواند اثر حفاظتی بر روی بافت کلیه داشته باشد [26 ،24].
مطالعات قبلی نشان داده است که آسیب سلولهای توبولی و نکروز شدن این سلولها سبب ریزش سلولها به داخل لومن توبول شده و تشکیل قالبهای پروتئینی در لومن توبول توسط جنتامایسین به دلیل اثرات استرس اکسیداتیو و التهاب است که میتواند سبب انسداد توبولی و افزایش فشار در داخل توبول و افزایش فضای کپسول بومن شود [25 ،3].
تأثیر عصاره اتانولی مرزنجوش بر آسیب کلیوی ناشی از پاراکورات نشان دادکه ترکیبات آنتیاکسیدانی فنولی و فلاونوئیدها اثرات حفاظتی دارند و نفوذ گلبولهای سفید در بافت بینابینی در کلیه را کاهش می دهند [18] که شبیه با نتایج این تحقیق است. اثرات ضد التهابی و آنتیاکسیدانی عصاره اتانولی مرزنجوش میتواند از آسیب بافتی جنتامایسین جلوگیری کند. همانند نتایج مطالعات قبلی، تجویز همزمان عصاره مرزنجوش با به دام انداختن رادیکالهای آزاد و همچنین کاهش التهاب سبب جلوگیری از آسیب بافتی جنتامایسین میشود [6].
در این تحقیق همانند مطالعات قبلی، جنتامایسین با ایجاد سمیت کلیوی سبب افزایش معنیدار در غلظت پلاسمایی کراتینین به دلیل کاهش کلیرانس کراتینین شد. درمان همزمان با عصاره اتانولی مرزنجوش در موشهای دریافتکننده جنتامایسین کلیرنس، کراتینین را به صورت معنیدار افزایش داد و سبب کاهش غلظت کراتینین پلاسما شد [33 ،16]. جنتامایسین با تولید ROS و انقباض سلولهای مزانژیال گلومرولی سبب کاهش فیلتراسیون گلومرولی شد و درنتیجه میزان کلیرنس کراتینین و اوره کاهش یافت که سبب افزایش غلظت کراتینین و اوره در خون میشود. کاهش رادیکالهای آزاد با استفاده از آنتیاکسیدانها از انقباض سلولهای مزانژیال و درنتیجه از کاهش میزان فیلتراسیون گلومرولی و از کاهش کلیرانس کراتینین جلوگیری میکند و سبب کاهش غلظت پلاسمای اوره و کراتینین میشود [1]. درمان همزمان با عصاره اتانولی مرزنجوش با توجه به اثرات آنتیاکسیدانی و به دام انداختن رادیکالهای آزاد با جلوگیری از سمیت کلیوی سبب افزایش کلیرنس کراتینین و کاهش غلظت اوره و کراتینین پلاسما شد [18].
نتیجهگیری
یافتههای این بررسی نشان داد که درمان همزمان با عصاره اتانولی مرزنجوش با خواص آنتیاکسیدانی، ضدالتهابی و متسعکننده رگی خود، کلیه موشهای صحرایی را در برابر آسیب کلیوی حاصل از جنتامایسین محافظت میکند. با انجام مطالعات بیشتر و شناسایی ماده یا مواد مؤثر موجود در عصاره اتانولی مرزنجوش و بررسی مکانیسم اثر آنها بر کلیه و مقایسه اثرات این ترکیبات با روشهای رایج در درمان میتوان آن را به عنوان یک داروی گیاهی برای جلوگیری از سمیت کلیوی جنتامایسین توصیه کرد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه در کمیته اخلاق پژوهشی دانشگاه علوم پزشکی اراک با کد اخلاق به تصویب رسید . تمامی کدهای اخلاقی کار با حیوانات آزمایشگاهی رعایت شد (کد اخلاق IR.ARAKMU.REC.1394284).
حامی مالی
این پژوهش حاصل طرح تحقیقاتی مصوب کمیته تحقیقات دانشجویی دانشگاه علوم پزشکی اراک است.
مشارکت نویسندگان
مفهومسازی و روششناسی و اعتبارسنجی و آنالیز و تحلیل دادهها: سعید حاجی هاشمی، انجام تحقیق و آزمایشها و جمع آوری دادهها، بررسی منابع و تهیه پیشنویس: راضیه رجبی و عاطفه غیاثآبادی فراهانی.
تعارض منافع
بدینوسیله نویسندگان اعلام میکنند که هیچگونه تضاد منافعی در خصوص پژوهش حاضر وجود ندارد.
تشکر و قدردانی
مؤلفان مراتب تشکر و قدردانی خود را از معاونت محترم تحقیقات و فناوری اطلاعات دانشگاه علوم پزشکی اراک بابت حمایتهای مالی از این تحقیق ابراز میکنند.
References
1.Randjelović P, Veljković S, Stojiljković N, Sokolović D, Ilić I. Gentamicin nephrotoxicity in animals: Current knowledge and future perspectives. EXCLI Journal. 2017; 16:388-99. [DOI:10.17179/excli2017-165] [PMID] [PMCID]
2.Quiros Y, Vicente-Vicente L, Morales AI, López-Novoa JM, López-Hernández FJ. An integrative overview on the mechanisms underlying the renal tubular cytotoxicity of gentamicin. Toxicological Sciences. 2011; 119(2):245-56. [DOI:10.1093/toxsci/kfq267] [PMID]
3.Nagai J, Takano M. Entry of aminoglycosides into renal tubular epithelial cells via endocytosis-dependent and endocytosis-independent pathways. Biochemical Pharmacology. 2014; 90(4):331-7. [DOI:10.1016/j.bcp.2014.05.018] [PMID]
4.Circu ML, Aw TY. Reactive oxygen species, cellular redox systems, and apoptosis. Free Radical Biology and Medicine. 2010; 48(6):749-62. [DOI:10.1016/j.freeradbiomed.2009.12.022] [PMID] [PMCID]
5.Morshedloo MR, Ahmadi H, Pirali Hamedani M, Yazdani D. [An over review to Origanum vulgare L. and its pharmacological properties (Persian)]. Journal of Medicinal Plants. 2018; 17(68):15-31. http://jmp.ir/article-1-2289-en.html
6.Oniga I, Pușcaș C, Silaghi-Dumitrescu R, Olah NK, Sevastre B, Marica R, et al. Origanum vulgare ssp. vulgare: Chemical composition and biological studies. Molecules. 2018; 23(8):2077. [DOI:10.3390/molecules23082077] [PMID] [PMCID]
7.Azizi H, Keshavarzi M. Ethnobotanical study of medicinal plants of Sardasht, Western Azerbaijan, Iran. Journal of Herbal Drugs. 2015; 6(2):113-9. http://jhd.iaushk.ac.ir/article_643571.html
8.Mombeini T, Mombeini M, Aghayi M. [Evaluation of pharmacological effects of Origanum genus (Origanum spp.) (Persian)]. Journal of Medicinal Plants. 2009; 8(29):18-35. http://jmp.ir/article-1-380-en.html
9.Ocaña-Fuentes A, Arranz-Gutiérrez E, Señorans FJ, Reglero G. Supercritical fluid extraction of oregano (Origanum vulgare) essentials oils: Anti-inflammatory properties based on cytokine response on THP-1 macrophages. Food and Chemical Toxicology. 2010; 48(6):1568-75. [DOI:10.1016/j.fct.2010.03.026] [PMID]
10.Zhang XL, Guo YS, Wang CH, Li GQ, Xu JJ, Chung HY, et al. Phenolic compounds from Origanum vulgare and their antioxidant and antiviral activities. Food Chemistry. 2014; 152:300-6. [DOI:10.1016/j.foodchem.2013.11.153] [PMID]
11.Mueller M, Lukas B, Novak J, Simoncini T, Genazzani AR, Jungbauer A. Oregano: A source for peroxisome proliferator-activated receptor γ antagonists. Journal of Agricultural and food Chemistry. 2008; 56(24):11621-30. [DOI:10.1021/jf802298w] [PMID]
12.Leyva-López N, Nair V, Bang WY, Cisneros-Zevallos L, Basilio Heredia J. Protective role of terpenes and polyphenols from three species of Oregano (Lippia graveolens, Lippia palmeri and Hedeoma patens) on the suppression of lipopolysaccharide-induced inflammation in RAW 264.7 macrophage cells. Journal of Ethnopharmacology. 2016; 187:302-12. [DOI:10.1016/j.jep.2016.04.051] [PMID]
13.Şahin F, Güllüce M, Daferera D, Sökmen A, Sökmen M, Polissiou M, et al. Biological activities of the essential oils and methanol extract of Origanum vulgare ssp. vulgare in the Eastern Anatolia region of Turkey. Food Control. 2004; 15(7):549-57. [DOI:10.1016/j.foodcont.2003.08.009]
14.Liu H, Zheng A, Liu H, Yu H, Wu X, Xiao C, et al. Identification of three novel polyphenolic compounds, origanine A-C, with unique skeleton from Origanum vulgare L. using the hyphenated LC-DAD-SPE-NMR/MS methods. Journal of Agricultural and Food Chemistry. 2012; 60(1):129-35. [DOI:10.1021/jf204406u] [PMID]
15.Hajihashemi S, Rajabi R, Ghiasabadi Farahani A. [The oral post-treatment effect of hydroethanolic extract of Origanum vulgare on acute kidney injury caused by gentamicin in rats (Persian-English)]. Journal of Arak University of Medical Sciences. 2019; 22(5):18-31. [DOI:10.32598/JAMS.22.5.18]
16.Hajihashemi S, Jafarian T, Ahmadi M, Rahbari A, Ghanbari F. Ameliorative effects of Zataria multiflora hydro-alcoholic extract on gentamicin induced nephrotoxicity in rats. Drug Research. 2018; 68(07):387-94. [DOI:10.1055/s-0043-124968] [PMID]
17.Ahmadi F, Hajihashemi S, Rahbari A, Ghanbari F. Effects of nitroglycerine on renal ischemia-reperfusion injury in adult male rats. Drug Research. 2019; 69(11):612-20. [DOI:10.1055/a-0958-1987] [PMID]
18.Sharifi-Rigi A, Heidarian E. Therapeutic potential of Origanum vulgare leaf hydroethanolic extract against renal oxidative stress and nephrotoxicity induced by paraquat in rats. Avicenna Journal of Phytomedicine. 2019; 9(6):563-73. [DOI:10.22038/AJP.2019.13466] [PMID] [PMCID]
19.Benzie IFF, Strain JJ. The Ferric Reducing Ability of Plasma (FRAP) as a measure of “antioxidant power”: The FRAP assay. Analytical Biochemistry. 1996; 239(1):70-6. [DOI:10.1006/abio.1996.0292] [PMID]
20.Ohkawa H, Ohishi N, Yagi K. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction. Analytical Biochemistry. 1979; 95(2):351-8. [DOI:10.1016/0003-2697(79)90738-3]
21.Al-Shabanah OA, Aleisa AM, Al-Yahya AA, Al-Rejaie SS, Bakheet SA, Fatani AG, et al. Increased urinary losses of carnitine and decreased intramitochondrial coenzyme A in gentamicin-induced acute renal failure in rats. Nephrology Dialysis Transplantation. 2010; 25(1):69-76. [DOI:10.1093/ndt/gfp457] [PMID]
22.Savin V, Karniski L, Cuppage F, Hodges G, Chonko A. Effect of gentamicin on isolated glomeruli and proximal tubules of the rabbit. Laboratory Investigation. 1985; 52(1):93-102. [PMID]
23.Karahan İ, Ateşşahin A, Yılmaz S, Çeribaşı AO, Sakin F. Protective effect of lycopene on gentamicin-induced oxidative stress and nephrotoxicity in rats. Toxicology. 2005; 215(3):198-204. [DOI:10.1016/j.tox.2005.07.007] [PMID]
24.Kaurinovic B, Popovic M, Vlaisavljevic S, Trivic S. Antioxidant capacity of Ocimum basilicum L. and Origanum vulgare L. extracts. Molecules. 2011; 16(9):7401-14. [DOI:10.3390/molecules16097401] [PMID] [PMCID]
25.Kaledaite R, Bernatoniene J, Majiene D, Dvorackova K, Masteikova R, Muselik J, et al. Investigation of antiradical activity of Salvia officinalis L., Urtica dioica L., and Thymus vulgaris L. extracts as potential candidates for a complex therapeutic preparation. Journal of Medicinal Plants Research. 2011; 5(25):6090-6. https://academicjournals.org/journal/JMPR/article-stat/4C5BDC821230
26.Ali NAM, Saeed SZ. Nephro-protective effect of Punica granatum in gentamicin-induced nephrotoxicity in rats. Medical Journal of Babylon. 2012; 9(1):220-8. https://www.iasj.net/iasj?func=fulltext&aId=35508
27.Gowrisri M, Sarita K, Vrushabendra Swamy BM, Archana Swamy P, Vishwanath KM. Anti-oxidant and nephroprotective activities of Cassia occidentalis leaf extract against gentamicin induced nephrotoxicity in rats. Research Journal of Pharmaceutical, Biological and Chemical Sciences. 2012; 3(3):684-94. https://www.researchgate.net/publication/286882273
28.Bae WK, Lee JU, Park JW, Bae EH, Ma SK, Kim SH, et al. Decreased expression of Na+/K+-ATPase, NHE3, NBC1, AQP1 and OAT in gentamicin-induced nephropathy. The Korean Journal of Physiology & Pharmacology. 2008; 12(6):331-6. [DOI:10.4196/kjpp.2008.12.6.331] [PMID] [PMCID]
29.Williams PD, Trimble ME, Crespo L, Holohan PD, Freedman JC, Ross CR. Inhibition of renal Na+, K+-adenosine triphosphatase by gentamicin. Journal of Pharmacology and Experimental Therapeutics. 1984; 231(2):248-53. [PMID]
30.Beltrán JMG, Espinosa C, Guardiola FA, Ángeles Esteban M. In vitro effects of Origanum vulgare leaf extracts on gilthead seabream (Sparus aurata L.) leucocytes, cytotoxic, bactericidal and antioxidant activities. Fish & Shellfish Immunology. 2018; 79:1-10. [DOI:10.1016/j.fsi.2018.05.005] [PMID]
31.Han F, Ma GQ, Yang M, Yan L, Xiong W, Shu JC, et al. Chemical composition and antioxidant activities of essential oils from different parts of the oregano. Journal of Zhejiang University-Science B. 2017; 18(1):79-84. [DOI:10.1631/jzus.B1600377] [PMID] [PMCID]
32.Hajihashemi S, Hamidizad Z, Rahbari A, Ghanbari F, Aghaee Motealeghi Z. Effects of Cobalamin (Vitamin B12) on gentamicin induced nephrotoxicity in rat. Drug Research. 2017; 67(12):710-8. [DOI:10.1055/s-0043-117418] [PMID]
33.Neugarten J, Aynedjian HS, Bank N. Role of tubular obstruction in acute renal failure due to gentamicin. Kidney International. 1983; 24:330-5. [DOI:10.1038/ki.1983.162] [PMID]
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |








