

Jafari M, Matinhomaee H, Rahmati Ahmadabad S. The effect of eight weeks of aerobic exercise and coriander seed extract on oxidative stress and cellular energy indices of heart tissue in male rats poisoned with hydrogen peroxide. cmja 2023; 13 (1) :43-51
URL:
http://cmja.arakmu.ac.ir/article-1-930-fa.html
جعفری مهدی، متین همایی حسن، رحمتی احمدآباد صالح. اثر هشت هفته تمرین هوازی و عصاره بذر گشنیز بر شاخصهای استرس اکسیداتیو و انرژی سلولی بافت قلب رتهای نر مسموم شده با آب اکسیژنه. فصلنامه طب مکمل. 1402; 13 (1) :43-51
URL: http://cmja.arakmu.ac.ir/article-1-930-fa.html
1- گروه فیزیولوژی ورزشی، واحد تهران مرکزی، دانشگاه آزاد اسلامی، تهران، ایران
2- گروه فیزیولوژی ورزشی، واحد تهران مرکزی، دانشگاه آزاد اسلامی، تهران، ایران ، hasanmatinhomaee@gmail.com
3- گروه تربیت بدنی، واحد پردیس دانشگاه آزاد اسلامی، پردیس، ایران
متن کامل [PDF 789 kb]
(829 دریافت)
|
چکیده (HTML) (1953 مشاهده)
متن کامل: (677 مشاهده)
مقدمه
بیماریهای قلبی عروقی (CVDs) یکی از علل اصلی مرگومیر و کاهش کیفیت زندگی در سراسر جهان محسوب میشود. افزایش فیبروز و تضعیف عملکرد قلبی از عدم تعادل وضعیت ردوکس بدن، افزایش رادیکالهای آزاد و ایجاد آسیب بافتی ناشی میشود (1). این روند تحت عنوان استرس اکسیداتیو یا آبشار نامطلوب اکسیداسیون احیا موجب تغییر ساختار مولکولهای مهم زیستی بافت خواهد شد. از بین مهمترین اکسیدانها، گونههای فعال اکسیژن (ROS) عامل اصلی آسیب اکسیداتیو هستند که در مختل کردن سیستم حفاظتی بدن از طریق سایر گونههای فعال مانند RNS نقش مهمی دارند (2). در این زمینه یکی از مهمترین موادی که نقش مهمی در افزایش استرس اکسیداتیو سیستم ایمنی، دستگاه تولیدمثل، پارامترهای مختلف بیوشیمیایی و خونی، کبد و کلیه و سلولهای پیش ساز الیگودندروسیت دارد، هیدروژن پراکسید یا آباکسیژنه (H2O2) است (3). نتایج نشاندهنده اثرات زیانبار این ماده از طریق ایجاد اختلال کارکردی در توازن پراکسیداسیون- آنتی اکسیدانی بدن است (4).
از جمله شاخصهای مهم برای سنجش میزان استرس اکسیداتیو یا فشار اکسایشی بدن میتوان به مالون دی آلدئید (MDA) به عنوان عامل پراکسیداسیون لیپیدی اشاره کرد. افزایش این شاخص یکی از محصولات عمده تخریب اسیدهای چرب غیراشباع توسط رادیکالهای آزاد هیدروکسیل میباشد (5). در این زمینه مسمومیتها با برهم زدن تقابل سـیتوکروم های c درگیر در تولید ATP میتوکندریایی، میزان انرژی سلولی را تحت تأثیر قرار میدهند (6). از طرفی ارزیابی شاخصی تحت عنوان تعادل ظریف تـولید و حذف گونههای اکـسیژن واکنشگر یا توازن پرواکسیدان– آنتی اکسیدان (PAB) اطلاعات دقیقی در مورد میزان استرس اکسیداتیو سلولی به ما میدهد (7). معمولاً در این شرایط ارگانیســـم جهت کاهش صـــدمات اکسایشی از چندین آنتی اکسیدان آنزیمی و غیرآنزیمی شــامل کاتالاز ((CAT، سوپراکسید دیسموتاز ((SOD، گلوتاتیون پراکسیداز (GPX) و ویتامینهای A، E و C استفاده خواهد کرد (6). با اینحال، یافتن راههای بازیابی کامل تعادل آنتی اکسیدانی به منظور پیشگیری و درمان بیماریهای ناشی از استرس اکسیداتیو ضروری به نظر میرسد.
بهدرستی ثابت شده است اتخاذ شیوههای مناسب زندگی از جمله انجام فعالیت ورزشی منظم سبب حفظ سلامتی در برابر بیماریهای مزمن میشود. در واقع فعالیتهای هوازی ظرفیت سازگاری بیوشیمیایی و متابولیکی بافتهای بدن را در مقابل شرایط فشارزا افزایش میدهند. از نظر پژوهشگران، 30 دقیقه فعالیت هوازی با شدت متوسط در 5 روز هفته با افزایش سطح چگالی مویرگی سبب بهبود اکسیژناسیون و کاهش ضربان قلب میشود (8). جمعبندی نتایج بیانگر اثرات مطلوب فعالیتهای هوازی در ایجـاد تعـدیلات جبرانی برخی شاخصهای اکســیداتیو از جمله ســوپراکســید دیســموتاز، گلوتاتیون پراکســیداز و کاتالاز متعاقب مســمومیت اســت. این آنزیمها با تبدیل H2O2 به H2O و O2 به ایفای نقش کلیدی در دفاع سلولی میپردازند (9). در طرف مقابل اجرای یک جلسه فعالیت بدنی وامانده ساز مقاومتی از طریق تولید پراکسید هیدروژن میتوکندری باعث افزایش سطح استرس اکسیداتیو بافت قلب میشود به نظر میرسد این فعالیتها با ایجاد التهاب بیش از حد موجب توسعه رادیکالهای آزاد و به موازات آن تضعیف سیستم دفاع آنتی اکسیدانی میشوند. از اینرو نقش دوگانه تمرینات ورزشی تابع ویژگیهای تمرین از جمله شدت، مدت و نوع آن است (10). با اینحال، مرور مطالعات نشاندهنده کمبود مطالعات در رابطه با اثر تمرینات هوازی بر تغییرات شاخصهای ATP و PAB مدلهای حیوانی مسموم شده با آب اکسیژنه براساس نوع بافت است. با اینکه از فعالیتهای هوازی به عنوان عامل کاهش سطوح پراکسیداسیون لیپیدی جوانان و افراد مسن یاد شده است، در این رابطه هنوز نتایج متناقضی وجود دارد. بعضی از محققان عدم تغییر یا افزایش میزان فعالیت MDA متعاقب تمرینات هوازی را به مدت زمان این تمرینات مربوط میدانند (11).
از آنجایکه میزان خنثیسازی آسیبهای اکسایشی ناشی از مسمومیت توسط فعالیت ورزشی بصورت ناقص انجام میشود (8, 9)، نقش عناصر آنتی اکسیدانی رژیم غذایی اهمیت روزافزونی مییابد. در این راستا جدیداً علاقه زیادی به مطالعه مکملهای گیاهی در کلاسهای مختلف فتوشیمیایی جهت ریکاوری یا تقویت سریع سیستمهای فیزیولوژیکی و ارتقای عملکرد ورزشی ایجاد شده است (12). در این راستا عصاره گشنیز با اثرگذاری بر مسیر کاسپاز- 3 درون سلولی و سایر مسیرهای آپوپتوز میتوکندری قادر به مهار سلولهای سرطانی است. در واقع آنتی اکسیدان های موجود در ریشه این گیاه با کاهش میزان تکثیر H2O2 از مهاجرت سلولهای سرطانی جلوگیری میکنند (13). از طرفی مصرف گشنیز به مدت 6 هفته در بیماران دیابت نوع دوم به طور قابلتوجهی موجب کاهش گلوکز پلاسما، کلسترول تامتری گلیسیرید و افزایش شاخصهای محافظتی قلبی عروقی شده است (14). به نظر میرسد بذر گشنیز با حذف رادیکالهای آزاد یک اثر حفاظتی بر شاخصهای استرس اکسیداتیو داشته باشد. از این منظر شواهد تحقیقاتی محدودی در مورد اثرات سودمند گیاه گشنیز بر شاخص MDA موشهای صحرایی مبتلا به آترواسکلروز وجود دارد (15). با اینحال، هنوز مطالعات انسانی و حیوانی کافی در خصوص اثر مصرف عصاره بذر گشنیز بر شاخصهای اکسیداتیو و انرژی سلولی بافت قلب تحت شرایط مسمومیت با H2O2 وجود ندارد.
بر مبنای موارد مطرحشده چگونگی واکنش سیستم ایمنی بدن هنگام مواجه با عوامل مختلکننده و ارتقادهنده فعالیتهای آنزیمی بدن نکتهای قابل بحث است. مکانیسم افزایش استرس اکسیداتیو ناشی از سمیت آب اکسیژنه با تمرکز بر اختلال در کارکردها منجر اتخاذ چنین رویکرد مطالعاتی شده است. این احتمال وجود دارد که به واسطه مکمل سازی عصاره بذر گشنیز و تمرین هوازی از عوارض مسمومیت با آب اکسیژنه جلوگیری کرد. در این زمینه مطالعات محدودی بصورت مجزا انجام شده و اطلاعات یکپارچهای در رابطه با استفاده همزمان از این مداخلات در بافت قلب در دسترس نیست. لذا هدف این مطالعه بررسی تأثیر 8 هفته تمرین هوازی و عصاره بذر گشنیز با دو دوز مصرفی بر غلظت بافتی ATP، MDA و PAB بافت قلب رتهای نر مسموم شده با آب اکسیژنه میباشد.
روش کار
با توجه به کنترل عوامل محیطی و متغیرهای مداخلهگر، این پژوهش آزمایشی با طرح تجربی (پسآزمون با گروه کنترل) و روش بالینی طبق دستورالعمل شورای اخلاق دانشکده تربیتبدنی با کد IR.IAU.PS.REC.1398.322 انجام شد. بدین منظور 42 موش صحرایی نر 10 تا 12 هفتهای (220-200 گرم) از دانشگاه علوم پزشکی شهید بهشتی تهران انتخاب و بطور تصادفی در 7 گروه کنترل، مسموم شده، مسمومیت+ گشنیز 1 (5 میلیگرم)، مسمومیت+ گشنیز 2 (10 میلیگرم)، مسمومیت+ تمرین، مسمومیت+ تمرین+ گشنیز 1، مسمومیت+ تمرین+ گشنیز 2 تقسیم و به مدت یک هفته در قفسههای مخصوص جوندگان از جنس پلی کربنات شفاف با کف دارای تراشههای تمیز چوبی در دمای محیطی 22 تا 24 درجه سانتیگراد، رطوبت 50 تا 55 درصد و چرخه تاریکی به روشنایی 12: 12 ساعت نگهداری شدند. در طول این دوره حیوانات از غذای آماده مخصوص موشها و آب مورد نیاز با بطریهای ویژه برخوردار بودند. در ادامه، گروهها توسط 100 میلیگرم به ازای هر کیلوگرم وزن بدن H2O2 (شرکت شیمی عناصر پاک) در طول یک هفته (یک روز در میان) بصورت تزریق زیر صفاقی پای راست مسموم شدند (16). بعد از پایان مدت سازگاری، آزمودنیهای هدف 5 جلسه در هفته با سرعت 15 متر در دقیقه در شیب صفر درجه به مدت 20 تا 40 دقیقه روی نوار گردان مخصوص حیوانات به منظور آشناسازی دویدند. برنامه تمرین هوازی این گروهها شامل هشت هفته (5 روز در هفته) دویدن روی نوارگردان با سرعت 20 متر در دقیقه به مدت 60 دقیقه در جلسه بین ساعات 8 تا 10 صبح بود. عمل سرد کردن نیز در انتهای هر تمرین با کاهش پلکانی سرعت در انتهای هر جلسه تمرین انجام شد. سایر گروهها در طول مداخله هیچگونه فعالیت ورزشی نداشته و درون قفس نگهداری شدند. در مرحله مداخله گیاهی 100 گرم پودر بذر گشنیز به مدت 24 ساعت در 150 میلیلیتر متانول خیس شد. محلول به دست آمده از طریق کاغذ شماره 441 فیلتر واتمن دو بار فیلتر شد. سپس مایع استخراج شده در حمام آب 50 درجه سانتیگراد جهت تبخیر الکل قرار گرفت. در نهایت عصاره بذر گشنیز با دوزهای 5 و 10 میلیگرم به ازای هر کیلوگرم با کمک دستگاه دسیکاتور حاصل و طی دو هفته به حیوانات هدف بصورت گاواژ تجویز شد (17).
چهل و هشت ساعت پس از پایان مداخلات، آزمودنیهای هر گروه (5 آزمودنی از روند پژوهش حذف شدند) در شرایط کاملاً مشابه با mg/kg 50-30 کتامین بیهوش و از قلب آنها توسط سرنگ 5 میلیلیتری خونگیری به عمل آمد. خون گرفته شده پس از ورود به تیوپهای مخصوص دارای نیتروژن مایع در فریزر منهای 30 درجه سانتیگراد نگهداری شد. بعد از تهیه سرم به میزان کافی، غلظت بافتی شاخصهای MDA، PAB و ATP طبق دستورالعملهای شرکت تولیدکننده کیت انجام شد. در این راستا جهت سنجش میزان مالون دی آلدئید 150 میکرولیتر اتیلن دی آمین تترا استیک اسید (EDTA) به نمونههای خونی اضافه و سپس با سرعت 2700 دور در دقیقه به مدت 7 دقیقه سانتریفیوژ شد. پلاسما و لایههای سطحی جدا شده از اریتروسیت ها به روش الایزا با کیتهای مخصوص شرکت مینیپولیس آمریکا مورد ارزیابی قرار گرفتند (18).
برای سنجش توازن پرواکسیدان- آنتی اکسیدان از کاتیون TMB به دلیل ویژگیهای الکتروشیمیایی و نوری آن و به عنوان شاخص اکسایش- کاهش استفاده گردید. در این روش، TMB رنگزا توسط پرواکسیدان ها به کاتیون رنگی اکسید و سپس در یک واکنش شیمیایی توسط آنتی اکسیدان ها به ترکیب بیرنگ تبدیل شد. در ادامه، یک منحنی استاندارد با استفاده از نسبتهای 0 تا 100 درصد پراکسید هیدروژن، 250 میکرومولار همراه با اسید اوریک 3 میلی مولار رسم شد. در نهایت مقادیر نسبت پرواکسیدان- آنتی اکسیدان در واحدهای HK بر مبنای درصد جذب پراکسید هیدروژن بیان شد (19). در نهایت جهت سنجش میزان ATP درون سلولی از کیت ارزیابی مدل KA1661 استفاده گردید. در این روش میزان فعالیت آنزیم لوسیفراز محلولها با افزودن سوسبترای کیت به نمونهها در دستگاه لومینومتر مدل Biolum lll شرکت TIANLONG تعیین شد. در این واکنش شدت نور ایجاد شده با میزان ATP نسبت مستقیم داشته و بصورت واحد µM/L بیان میشود (20).
در بخش تجزیهوتحلیل از شاخصهای میانگین و انحراف استاندارد جهت توصیف دادهها و از آزمون شاپیرو- ویلک جهت تعیین توزیع نرمال بودن دادهها استفاده گردید. به منظور تعیین اثر مسمومیت با آب اکسیژنه آزمون تی مستقل و جهت آزمون فرضیهها تحلیل واریانس دوراهه مورد استفاده قرار گرفت. در صورت مشاهده تفاوت معنیدار، جهت تعیین محل تفاوت از آزمون تعقیبی بن فرونی استفاده شد. کلیه عملیاتهای آماری با استفاده از نرمافزار SPSS نسخه 22 در سطح معناداری 05/0 انجام شد.
یافتهها
مسمومیت با آب اکسیژنه منجر به کاهش معنادار غلظت ATP و افزایش معنادار غلظت MDA و PAB بافت قلب شد (جدول 1). در بررسی اثر مداخلات، هشت هفته تمرین هوازی (0.015, ƞ=0.224, P=0.196F=) اثر معناداری بر غلظت ATP این بافت نداشت؛ در حالیکه مصرف عصاره بذر گشنیز (0.615, ƞ=0.006, P=5.574F=) و ترکیب تمرین و عصاره بذر گشنیز (0.403, ƞ=0.018, P=3.490F=) باعث افزایش معنیدار غلظت ATP شد. براساس تحلیل تعقیبی بن فرونی بین میزان اثرات افزایشی دوزهای عصار بذر گشنیز بر غلظت این شاخص تفاوت معناداری وجود داشت (05/0P<)، اما بین اثرات ترکیبی دوزهای 5 و 10 میلیگرم عصاره با تمرین هوازی تفاوتی ملاحظه نشد (05/0P>) (شکل 1). در رابطه با غلظت MDA قلبی، تمرین هوازی (0.501, ƞ=0.009, P=4.682F=) و دریافت عصاره بذر گشنیز (0.477, ƞ=0.022, P=4.055F=) باعث کاهش معنادار غلظت شد. تعامل تمرین و عصاره بذر گشنیز نیز اثر کاهشی بر مقادیر این شاخص داشت (0.662, ƞ=0.008, P=8.502F=). براساس نتایج آزمون تعقیبی تنها مصرف 10 میلیگرم دوز عصاره بذر گشنیز موجب این اثر کاهشی شده است (05/0>P). از طرفی بیشترین کاهش معنادار هنگام ترکیب 10 میلیگرم دوز عصاره با تمرین هوازی قابل مشاهده بود (05/0>P) (شکل 2). در نهایت مصرف دو دوز عصاره بذر گشنیز در هشت هفته اثر معناداری بر توازن پرواکسیدان- آنتی اکسیدان نداشت (0.081, ƞ=0.257, P=0.733F=). با اینحال تمرین هوازی (0.538, ƞ=0.008, P=4.723F=) و تعامل تمرین و عصاره بذر گشنیز (0.636, ƞ=0.005, P=6.005F=) سبب کاهش معنادار این شاخص شد. از طرفی نتایج آزمون تعقیبی حاکی از عدم تفاوت معنادار بین میزان غلظت PAB گروههای تعاملی با یکدیگر بود (05/0P>) (شکل 3).
جدول 1. تغییرات شاخصهای اکسیداتیو بافت قلب پس از القای مسمومیت با H2O2
| متغیر |
گروه کنترل |
گروه مسموم شده |
t |
P-Value |
| ATP(μM) |
10/0±31/1 |
03/0±34/0 |
712/24 |
001/0 |
| MDA (pmol/ml) |
5/0±602/0 |
15/0±910/1 |
206/21 |
001/0 |
| PAB (HK) |
43/0±74/0 |
39/0±54/1 |
286/24 |
001/0 |
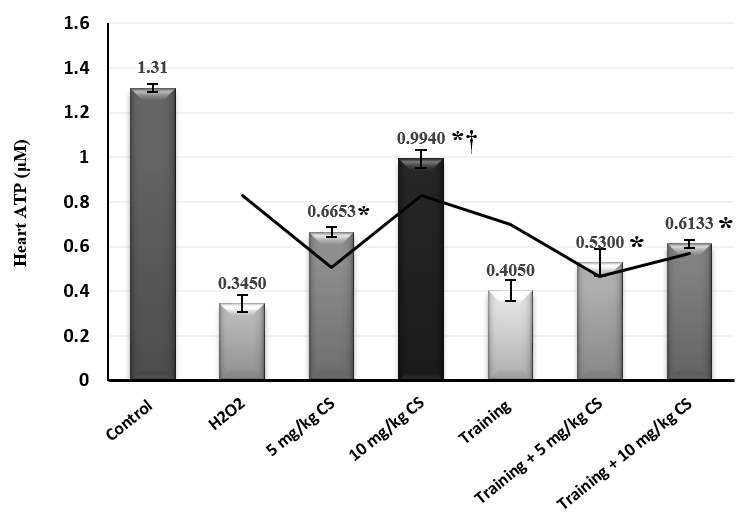 شکل 1. غلظت ATP بافت قلب گروههای مورد مطالعه. * افزایش معنادار نسبت به گروه مسمومیت،
*† افزایش معنادار نسبت به سایر گروههای مداخله
شکل 1. غلظت ATP بافت قلب گروههای مورد مطالعه. * افزایش معنادار نسبت به گروه مسمومیت،
*† افزایش معنادار نسبت به سایر گروههای مداخله
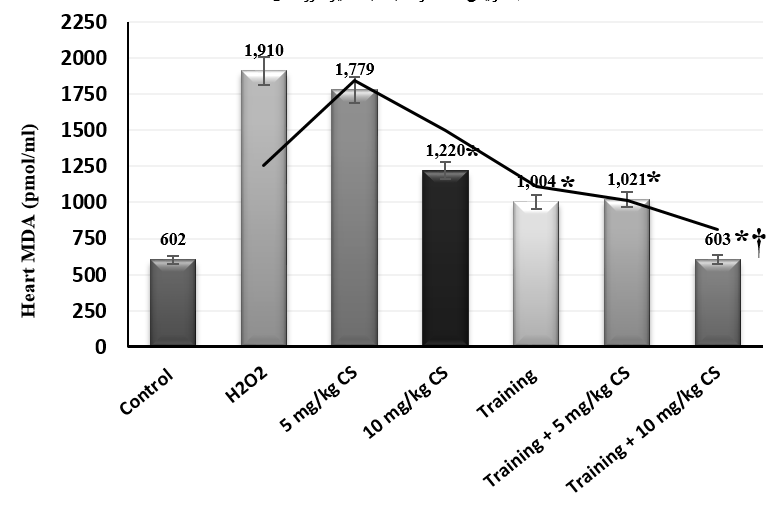 شکل 2. غلظت MDA بافت قلب گروههای مورد مطالعه. * کاهش معنادار نسبت به گروه مسمومیت،
*† کاهش معنادار نسبت به سایر گروههای مداخله
شکل 2. غلظت MDA بافت قلب گروههای مورد مطالعه. * کاهش معنادار نسبت به گروه مسمومیت،
*† کاهش معنادار نسبت به سایر گروههای مداخله
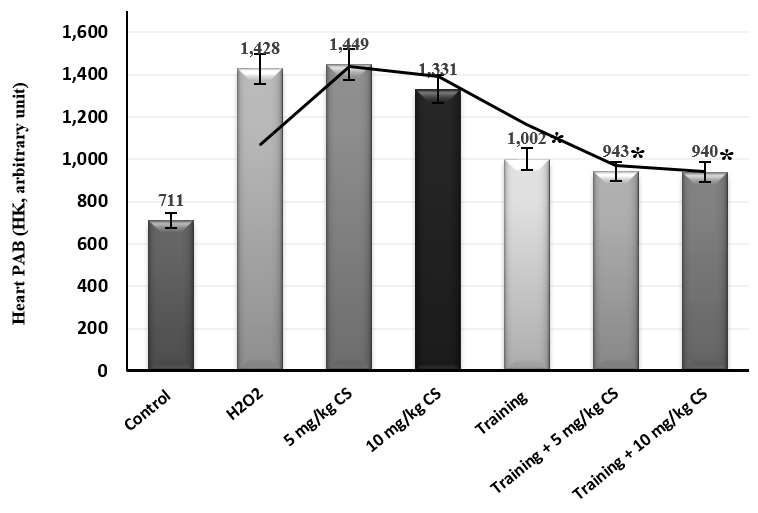
شکل 3. غلظت PAB بافت قلب گروههای مورد مطالعه. * کاهش معنیدار نسبت به گروه مسمومیت
بحث
اهم نتایج این مطالعه نشان داد القای مسمومیت با H2O2 سبب کاهش میزان ATP، افزایش MDA و PAB در حیوانات میشود. از لحاظ علمی سطوح بالای H2O2 سبب تولید رادیکالهای هیدروکسیل، آپوپتوز و نکروز در سلولهای بافت بسته به وضـــعیت فیزیولوژیکی، مدت زمان قرارگیری و غلظت ماده میشود (21). این یافته با مطالعات جانرو و همکاران (1991)، اکبری و همکاران (2018) و سیفی و همکاران (2019) همخوانی دارد (22-24). بر این اساس H2O2 از طریق آسیب جدی به سارکولمای سلول یا تأثیرگذاری بر کارایی فاکتورهای رونویسی مسیر انتقال سیگنال، باعث ایجاد اختلالاتی در سطح مالون دی آلدئید، پراکسیداسیون فسفولیپید، ATP و نسبت PAB میشود. این تغییرات در فرآیندهای سلولی رشد، تکثیر، تمایز و پیری با بیماریهای مرتبط با استرس اکسیداتیو از جمله دیابت، ایسکمی، کاهش شنوایی، اختلالات قلبی و عصبی، شروع و پیشرفت تومور همراه است (25). از طرفی بر مبنای ادبیات نظری، آب اکسیژنه مایع خارج سلولی میتواند منشأ میتوکندریایی داشته باشد. در این موارد پراکسید هیدروژن به راحتی از غشای دو لایه میتوکندری و پلاسمای سلولی عبور و وارد فضای خارج سلولی میشود (26). در این زمینه بیشترین مقدار افزایش سطوح آب اکسیژنه خارج سلولی در طی دو آزمون توان هوازی (آزمون بروس) و بیهوازی (آزمون وینگیت) دیده شده است، در حالیکه 8 هفته تمرین ورزشی هوازی تأثیری بر افزایش سطوح این ماده پلاسمایی نداشته است (27).
در خصوص شاخص انرژی سلولی نتایج نشاندهنده عدم افزایش معنادار این شاخص متعاقب استفاده از 8 هفته تمرین هوازی بود. ظاهراً مهمترین مکانیسم فیزیولوژیکی مقابله با استرس اکسیداتیو ناشی از مسمومیت، فعال کردن مسیرهای سیگنالی ROS، PI3K/Akt، پروتئین کینازهای c(PKCs)، پمپهای سدیم- پتاسیم و کانالهای پتاسیمی حساس به تغییرات ATP میتوکندریایی هستند (28). با اینکه در این مطالعه میزان تغییرات فعالیت مسیرهای سیگنالی PKC بررسی نشده است، اما ظاهراً استفاده از هشت هفته فعالیت هوازی قادر به تعدیل مثبت این فرآیندها نیست. از طرفی، احتمالاً عوامل متعددی از جمله نوع بافت بررسی شده، آمادگی قلبی- عروقی و سازگاریهای ویژه فعالیت بدنی بر غلظت ATP سلولی و عضلانی اثرگذار است. آنچه که مسلم است فعالیتهای ورزشی از جمله عوامل قابل بررسی در زمینه تغییرات غلظت ATP است؛ زیرا تاکنون نتایج متفاوتی در این رابطه گزارش شده است. قنبری و همکاران (2011) در بررسی اثر 60 دقیقه تمرین استقامتی با شدت 25 متر بر دقیقه در سه گروه تمرین کوتاهمدت (3 هفته)، متوسط (9 هفته) و بلندمدت (12 هفته) نشان دادند که تمرین استقامتی کوتاهمدت و بلندمدت موجب افزایش معنادار غلظت ATP کبدی میشود، در حالیکه 9 هفته تمرین تغییری در غلظت شاخص ایجاد نمیکند (29). شکوهی راد و همکاران (2020) در بررسی 8 هفته تمـرین هوازی بروی تردمیل بـر نشـانگان فشـار اکسیداتیو عضلات کند انقباض موشهای صحرایی نر مسموم شـده بـا پراکسید هیدروژن نشان داد که غلظت ATP عضله نعلی بطور معنیداری افزایش داشت (18). همچنین جعفری و همکاران (2022) در مطالعه اثر مداخلات مشابه نشان دادند که هشــت هفته تمرین هوازی غلظت ATP ریوی را بصــورت معناداری افزایش میدهد. از دلایل تفاوت در نتایج میتوان به تغییر متابولیت ها در اثر نوع تمرین اشاره کرد (30). از نظر پژوهشگران مهمترین علت کاهش ATP تلاش بافتها برای کاهش لاکتات تولیدی در طی تمرین است (31). بنابراین، عواملی مانند شدت، مدت و طول دوره تمرین به همراه فاصله آخرین جلسه تمرین تا بیهوشی میتوانند در غلظت ATP قلبی نقش مهمی داشته باشند.
در پژوهش ما مصرف هشت هفته عصاره بذر گشنیز با دو دوز 5 و 10 میلیگرم باعث تعدیل اثر مسمومیت بصورت افزایش معنیدار غلظت ATP شد. در این رابطه مطالعهای تحت عنوان بررسی اثر عصاره بذر گشنیز بر میزان ATP قلبی یافت نشد؛ با اینحال جعفری و همکاران (2022) این اثر را در بافت ریه هنگام مصرف 10 میلیگرم عصاره بذر گشنیز مشاهده کردند (30). اگرچه به نظر میرسد بیشترین میزان اثرگذاری بر شارژ سلولی- بافتی در دوزهای بالاتر بذر گشنیز قابل مشاهده است، ظاهراً اثرگذاری دوزهای پایین عصاره به نوع بافت مورد مطالعه بستگی دارد. در این رابطه نتایج آزمون بن فرونی نشان داد بیشترین غلظت پایانی ATP قلبی در گروه دریافتکننده 10 میلیگرم عصاره بذر گشنیز نسبت به دوز 5 میلیگرم و سایر گروهها قابل مشاهده است. این نتایج با توجه به اثرات ضد التهابی و آنتی اکسیدانی مواد معدنی عصاره در درمان بیماریهای عروق کرونر، انفارکتوس میوکارد و آترواسکروز تا حدودی قابل توجیه است (32). در واقع فلاونییدهای گیاه بذر گشنیز از طریق کاهش اندازه ناحیه ایسکمیک موجب کاهش فشارخون وابسته به دوز و محافظت از قلب میشود. در این مکانیسم حداقل 2 گرم از عصاره این گیاه میتواند موجب آزاد شدن نیتریک اکسید و هیپرپلاریزه شدن غشای عضلات صاف دیواره عروق و در نتیجه انبساط عروقی شود (33). از اینرو، هر کدام از دوزهای 5 و 10 میلیگرم عصاره بذر گشنیز به تنهایی قادر به کنترل افزایش استرس اکسیداتیو ناشی از مسمومیت با آب اکسیژنه در بافت قلب هستند.
از نظر بیوشیمیایی افزایش سطح مالون دی آلدئید بافتی یکی از اثرات افزایش رادیکالهای آزاد پس از مسمومیت با آب اکسیژنه است. نتایج ما نشان داد اثرات مفید عصاره بذر گشنیز میتواند وابسته به دوز مصرفی باشد؛ زیرا مصرف 5 میلیگرم این عصاره باعث کاهش معنادار سطح MDA نشده است. با اینکه در رابطه با اثرات گیاه بذر گشنیز بر شاخص پراکسیداسیون لیپیدی مطالعات محدودی وجود دارد، در پژوهشهای موردی مصرف بیش از حد آن موجب سمیت بافت کلیه، کبد و سیستم عصبی شده است (34). همچنین جعفری و همکاران (2022) خاطر نشان کردند مصرف دوزهای 5 و 10 میلیگرم عصاره بذر گشنیز در هشت هفته موجب تعدیل MDA ریوی موشهای مسموم شده نمیشود (30). از طرفی هشت هفته تمرین هوازی اثر معنیداری در کاهش این شاخص قلبی موشهای مسموم شده داشته است. در این راستا دبیدی روشن و اشرفی (2016) نشان دادند 8 هفته تمرین منظم هوازی جهت تنظیم کاهشی مالون دی آلدئید ضروری است (35). براساس یافتههای اعظمیان و همکاران (2017) و زنگ و همکاران (2017) نیز سطح پلاسمایی شاخص مالون دی آلدئید پس از 8 هفته تمرین هوازی با شدت متوسط به طور معناداری در افراد سالم و بیمار کاهشی میشود (36, 37). با اینحال طبق گزارش دیابا و همکاران (2018) سطوح مالون دی آلدئید و آنتیاکسیدانهای سوپراکسید دیسموتاز و اسید اوریک ورزشکاران متناسب با شدت فعالیت، افزایش مییابد (38). شکوهی راد و همکاران (2020) نشان دادند پس از 8 هفته تمرین هوازی روزانه، غلظت MDA عضلات نعلی بصورت معناداری افزایشی و در عضلات کفپایی بدون تفاوت معنیدار است (18). همچنین از نظر برخی محققان استفاده از تمرینات مجزای هوازی و در ترکیب با سایر مکملها باعث ایجاد تغییرات معنادار در میزان مالون دی آلدئید ریوی نمیشود (30). اینکه کدام عامل میتواند توجیهکننده عدمتغییر یا افزایش سطح مالون دی آلدئید پس از تمرینات هوازی باشد، نکته قابل بحثی است. ظاهراً جنسیت عامل تعیینکننده تغییرات MDA بافتها و عضلات اسکلتی پس از فعالیتهای شدید یا استقامتی است (39). بر مبنای نتایج ما این احتمال نیز وجود دارد که شدت و مدت تمرین به کار رفته تنها سبب ایجاد سازگاریهای ویژه در سیستم اکسایشی بافت قلب شده باشد. این یافتهها سؤالات جدیدی را مطرح میکند، از اینرو در پژوهشهای بعدی با ارزیابی میزان فعالیت این آنزیم در بافتهای مختلف دو جنس نر و ماده میتوان به تفسیرهای دقیقتری رسید.
در نهایت نتایج این مطالعه نشان داد هشت هفته تمرین هوازی باعث کاهش معنادار توازن پرواکسیدان- آنتی اکسیدان بافت قلب در مقایسه با مصرف 5 و 10 میلیگرم مکمل بذر گشنیز میشود. در واقع مکمل عصاره بذر گشنیز به تنهایی قادر به تغییر معنادار PAB قلبی نیست. نکته قابلتوجه این بود که علیرغم انتظار پژوهشگران با افزایش دوز مصرفی کاهش معناداری در مقادیر این شاخص مشاهده نشد. معمولاً PAB به عنوان شاخصی از میزان فعالیت استرس اکسیداتیو در مقایسه با سیستم آنتی اکسیدانی در نظر گرفته میشود. براساس تحقیقات اولیه سازگاریهای ناشی از پنج روز فعالیت بدنی منظم با تأثیر بر نسبت سوپراکسید به پراکسید از بیماریهای قلبی- عروقی جلوگیری میکند (40). پیلچ و همکاران (2014) نشـان دادند تمرین با دوچرخه ارگومتر موجب افزایش آنتی اکسیدان ها مردان ورزشـــکار و غیر ورزشکار میشود اما گرما موجب تمایل PAB به سوی وضــعیت اکســیدانی بهویژه در غیر ورزشـــکـاران خواهد شد (41). رح و همکاران (2016) با اشاره به ســطوح بالاتر ROS و ســطوح پایینتر SOD آزمودنیها چاق نشان داد تمرین هوازی با معکوس سازی مقادیر شاخصها سبب بهبود تعادل اکســیدانی- آنتی اکســیدانی خواهد شد (42). همراستا با نتایج ما شکوهی راد و همکاران (2020) و جعفری و همکاران (2022) نشان دادند میزان PAB پس از 8 هفته تمـرین اسـتقامتی در عضله نعلی و بافت ریه موشهای صحرایی نر کاهش یافت (18, 30). از نظر شمس و همکاران (2020) تمرین هوازی با افزایش معنیدار غلظت گلوتاتیون پراکسیداز (GPx) موجب کاهش معنیدار تعادل PAB میشود (43). از میان آنزیمهای ضداکسایشی، GPx دارای پایدارترین تغییرات بوده که در غلظتهای کم ســوبســترای خود یعنی H2O2 پایین نیز وارد عمل میشود. در این صورت بدیهی است بیشترین تغییرات ســازشــی در ارتباط با این آنزیم مشــاهده شــود. از طرفی GPx با آنزیم دیگری به نام گلوتاتیون ردوکتاز و نیز یک پپتید (تیول) با وزن مولکولی پایین به نام گلوتاتیون به عنوان اولین خط دفاعی در برابر اکسایش هیدروژن پراکســیداز عمل میکند. در این فرآیند GPx برای کاهش هیدروژن داخل زنجیره انتقال الکترون و تبدیل آن به آب و نیز کاهش پراکســیدهای ارگانیکی و تبدیل آن به الکل از گلوتاتیون GSH استفاده میکند (44). پس کاهش معنیدار شیفت پرواکسیدان-آنتی اکسیدان قلبی پس از هشت هفته تمرین هوازی را میتوان به افزایش معنیدار GPx و نقش آن در تبدیل H2O2 به آب در بافت نسبت داد. با اینحال در پژوهش ما تغییرات غلظت GPx متعاقب تمرینات هوازی مورد ارزیابی قرار نگرفته است تا بتوان درباره این موضوع اظهارنظر قطعی انجام داد.
در رابطه با نتایج این پژوهش در مورد عدم اثر کاهنده دوزهای مصرفی عصاره بذر گشنیز بر شاخص PAB قلبی سؤالات زیادی وجود دارد؛ زیرا محققان کماکان توصیه به استفاده همزمان از مکملهای گیاهی بدلیل خواص آنها در مقابله با استرس اکسیداتیو ناشی از فعالیت بدنی دارند (10). در پژوهش وانگ و همکاران (2021) فلاونییدهای مشتق از گیاه بذر گشنیز از طریق فعال نمودن مسیر سیگنالینگ PKC باعث کاهش آسیب سلولی و در نتیجه کاهش شدت آپوپتوز سلولی شده است (45). همچنین در یافتههای جعفری و همکاران (2022) مکمل بذر گشنیز با افزایش سطح آنتی اکسیدان های غیرآنزیمی بدن و تشدید فعالیت آنزیمهای آنتی اکسیدانی باعث شیفت آنتی اکسیدانی شده است (30).
ظاهراً تلفیق هشت هفته تمرین هوازی با دوزهای 5 و 10 میلیگرم عصاره بذر گشنیز اثر متفاوتی بر غلظت شاخصهای مورد بررسی بافت قلب دارد. در این زمینه همزمانی دو مداخله دارای اثر فراینده بیشتری بر غلظت ATP نسبت به اثر تکی دوزهای عصاره نیست. از اینرو تصور ما بر این است که ترکیب هشت تمرین هوازی با این مکمل میزان افزایش مقادیر شاخص را مهار میکند. به نظر میرسد این موضوع در رابطه با شاخص PAB کاملاً معکوس باشد، بطوریکه مشاهده اثرات معنادار گروههای تلفیقی مربوط به اثر هشت هفته تمرین هوازی است. از طرفی ترکیب هشت هفته تمرین هوازی با 10 میلیگرم بذر گشنیز قادر به کاهش معنیدار غلظت مالون دی آلدئید قلبی تا سطح پایه (گروه کنترل) است. شایان ذکر است تاکنون پژوهشی مبنی بر بررسی اثرات ترکیبی فعالیتهای هوازی و مصرف گیاه بذر گشنیز بر شاخصهای اکسیدانی و آنتی اکسیدانی انجام نشده است تا بتوان این نتایج را در بافتهای مختلف مقایسه کرد. از اینرو، سازوکار اثر تعاملی این مداخلات بر تغییرات شاخصهای مدنظر واضح نیست. اینکه پس از استفاده ترکیبی از این مداخلات میزان فعالیت آنتیاکسیدانهای آنزیمی مانند سوپر اکسید دیسموتاز، کاتالاز، پراکسیداز، GPx، گلوکز 6- فسفات دهیدروژناز و آسکوربات اکسیداز دچار چه تغییراتی میشود؛ نیاز به بررسی دارد. با توجه به اینکه شاخصهای مختلف مسیرهای آپوپتوزی و ضد آپوپتوزی احتمالاً تغییرات متفاوتی پس از مسمومیت با H2O2 بروز میدهند، پیشنهاد میشود مطالعاتی در زمینه اثرات تمرینات هوازی همراه با مصرف بذر گشنیز بر این شاخصها در رت های مسموم شده انجام گیرد.
نتیجهگیری
به نظر میرسد تمرین هوازی و عصاره بذر گشنیز هر کدام راهکار ویژهای جهت تعدیل شاخصهای خاص اکسیداتیو ناشی از مسمومیت با آب اکسیژنه در بافت قلب هستند. همچنین اثرات عصاره بذر گشنیز ممکن است در مواردی وابسته به دوز باشد. با این وجود ترکیب تمرین هوازی و مصرف عصاره بذر گشنیز دارای اثرات یکسانی در همه موارد نیست. از آنجایکه تغییرات مشاهده شده در شاخصها با سطوح پایه آزمودنیها فاصله آشکاری داشت، احتمالاً باید از دورههای تمرینی طولانیتر و دوزهای دارویی بیشتری استفاده نمود. همچنین عواملی مانند عدم امکان کنترل اشتهای موشها، استفاده از موشهای با نژاد خاص، تغییرات فیزیولوژیکی احتمالی ناشی از محیط آزمایشگاه و عدم استفاده از دارونما و شبه دارو ممکن است روی نتایج پژوهش اثرگذار بوده باشد.
تشکر و قدردانی
یافتههای این مقاله منتج از رساله دوره دکتری بروی یک مگاپروژه بوده و بدینوسیله از همه دوستان، همکاران و معاونت محترم پژوهشی دانشگاه آزاد اسلامی واحد تهران مرکز که امکانات لازم را جهت اجرا و پیشبرد اهداف در اختیار ما قرار دادند، تشکر و قدردانی میشود.
References
1. Roth GA, Mensah GA, Fuster V. The Global Burden of Cardiovascular Diseases and Risks: A Compass for Global Action. J Am Coll Cardiol. 2020;76(25):2980-2981. doi: 10.1016/j.jacc.2020.11.021 pmid: 33309174
2. Sies H, Jones DP. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nat Rev Mol Cell Biol. 2020;21(7):363-383. doi: 10.1038/s41580-020-0230-3 pmid: 32231263
3. Andrisic L, Dudzik D, Barbas C, Milkovic L, Grune T, Zarkovic N. Short overview on metabolomics approach to study pathophysiology of oxidative stress in cancer. Redox Biol. 2018;14:47-58. doi: 10.1016/j.redox.2017.08.009 pmid: 28866248
4. Rampon C, Volovitch M, Joliot A, Vriz S. Hydrogen Peroxide and Redox Regulation of Developments. Antioxidants (Basel). 2018;7(11). doi: 10.3390/antiox7110159 pmid: 30404180
5. Algul S, Uğraş S. Comparative Evaluation of MDA Levels During Aerobic Exercise in Young Trained and Sedentary Male Subjects. Eastern J Med. 2018;23:98-101. doi: 10.5505/ejm.2018.40469
6. Ighodaro OM, Akinloye OA. First line defence antioxidants-superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GPX): Their fundamental role in the entire antioxidant defence grid. Alexandria J Med. 2018;54(4):287-293. doi: 10.1016/j.ajme.2017.09.001
7. Ghazizadeh H, Saberi-Karimian M, Aghasizadeh M, Sahebi R, Ghazavi H, Khedmatgozar H. Pro-oxidant antioxidant balance (PAB) as a prognostic index in assessing the cardiovascular risk factors: A narrative review. Obesit Med. 2020;19:100272. doi: 10.1016/j.obmed.2020.100272
8. Tian D, Meng J. Exercise for Prevention and Relief of Cardiovascular Disease: Prognoses, Mechanisms, and Approaches. Oxid Med Cell Longev. 2019;2019:3756750. doi: 10.1155/2019/3756750 pmid: 31093312
9. Thirupathi A, Pinho RA, Ugbolue UC, He Y, Meng Y, Gu Y. Effect of Running Exercise on Oxidative Stress Biomarkers: A Systematic Review. Front Physiol. 2020;11:610112. doi: 10.3389/fphys.2020.610112 pmid: 33551836
10. Simioni C, Zauli G, Martelli AM, Vitale M, Sacchetti G, Gonelli A, et al. Oxidative stress: role of physical exercise and antioxidant nutraceuticals in adulthood and aging. Oncotarget. 2018;9(24):17181-17198. doi: 10.18632/oncotarget.24729 pmid: 29682215
11. Lu Y, Wiltshire HD, Baker JS, Wang Q. Effects of High Intensity Exercise on Oxidative Stress and Antioxidant Status in Untrained Humans: A Systematic Review. Biology (Basel). 2021;10(12). doi: 10.3390/biology10121272 pmid: 34943187
12. Bobadilla M, Garcia-Sanmartin J, Martinez A. Natural Food Supplements Reduce Oxidative Stress in Primary Neurons and in the Mouse Brain, Suggesting Applications in the Prevention of Neurodegenerative Diseases. Antioxidants (Basel). 2021;10(1). doi: 10.3390/antiox10010046 pmid: 33401699
13. Tang EL, Rajarajeswaran J, Fung S, Kanthimathi MS. Petroselinum crispum has antioxidant properties, protects against DNA damage and inhibits proliferation and migration of cancer cells. J Sci Food Agric. 2015;95(13):2763-2771. doi: 10.1002/jsfa.7078 pmid: 25582089
14. Kajal A, Singh R. Coriandrum sativum seeds extract mitigate progression of diabetic nephropathy in experimental rats via AGEs inhibition. PLoS One. 2019;14(3):e0213147. doi: 10.1371/journal.pone.0213147 pmid: 30845182
15. Hosseinzadeh H, Alaw Qotbi AA, Seidavi A, Norris D, Brown D. Effects of different levels of coriander (Coriandrum sativum) seed powder and extract on serum biochemical parameters, microbiota, and immunity in broiler chicks. ScientificWorldJournal. 2014;2014:628979. doi: 10.1155/2014/628979 pmid: 25614892
16. Kumar S, Srivastava N, Gomes J. The effect of lovastatin on oxidative stress and antioxidant enzymes in hydrogen peroxide intoxicated rat. Food Chem Toxicol. 2011;49(4):898-902. doi: 10.1016/j.fct.2010.12.014 pmid: 21184795
17. Zargar-Nattaj SS, Tayyebi P, Zangoori V, Moghadamnia Y, Roodgari H, Jorsaraei SG, et al. The effect of Coriandrum sativum seed extract on the learning of newborn mice by electric shock: interaction with caffeine and diazepam. Psychol Res Behav Manag. 2011;4:13-19. doi: 10.2147/PRBM.S15905 pmid: 22114531
18. Shokohi Rad N, Bagherpour T, Nemati N, Hojati V. The effect of pumpkin seed and endurance training on oxidative stress factors and DNA damage. Daneshvar Med. 2020;28(3):28-41. doi: magiran.com/p2164926
19. Tavana S, Amini S, Hakhamaneshi MS, Andalibi P, Hajir MS, Ardalan A, et al. Prooxidant-antioxidant balance in patients with phenylketonuria and its correlation to biochemical and hematological parameters. J Pediatr Endocrinol Metab. 2016;29(6):675-680. doi: 10.1515/jpem-2015-0398 pmid: 27008692
20. Belleannee C, Da Silva N, Shum WW, Brown D, Breton S. Role of purinergic signaling pathways in V-ATPase recruitment to apical membrane of acidifying epididymal clear cells. Am J Physiol Cell Physiol. 2010;298(4):C817-830. doi: 10.1152/ajpcell.00460.2009 pmid: 20071692
21. Juan CA, Perez de la Lastra JM, Plou FJ, Perez-Lebena E. The Chemistry of Reactive Oxygen Species (ROS) Revisited: Outlining Their Role in Biological Macromolecules (DNA, Lipids and Proteins) and Induced Pathologies. Int J Mol Sci. 2021;22(9). doi: 10.3390/ijms22094642 pmid: 33924958
22. Akbari M, Shahidi F, Rajabi H, Kashef M, Maaheri Z. The simultaneous effect of six-week forced swimming and crocin supplementation on the expression of 3-cardiomyocyte gene caspase 3 in male rats infected with hydrogen peroxide. RAZI J MED SCI (J IRAN UNIV MED SCI). 2018;25(9):l00496. doi: 20.1001.1.22287043.1397.25.9.9.8
23. Janero DR, Hreniuk D, Sharif HM. Hydrogen peroxide-induced oxidative stress to the mammalian heart-muscle cell (cardiomyocyte): lethal peroxidative membrane injury. J Cell Physiol. 1991;149(3):347-364. doi: 10.1002/jcp.1041490302 pmid: 1744169
24. Seyfi A, Shahidi F, Salehpor M. Seyfi A, Shahidi F, Salehpor M. The Interactive Effect of Crocin Supplementation on the Alteration of Malondialdehyde and Cardiomyocyte Catalase in Male Rats Poisoned with Hydrogen Peroxide. Qom Univ Med Sci J. 2019;13(8):5-13. doi: 10.29252/qums.13.8.5
25. Petersen AB, Gniadecki R, Vicanova J, Thorn T, Wulf HC. Hydrogen peroxide is responsible for UVA-induced DNA damage measured by alkaline comet assay in HaCaT keratinocytes. J Photochem Photobiol B. 2000;59(1-3):123-131. doi: 10.1016/s1011-1344(00)00149-4 pmid: 11332879
26. Park WH. Hydrogen peroxide inhibits the growth of lung cancer cells via the induction of cell death and G1‑phase arrest. Oncol Rep. 2018;40(3):1787-1794. doi: 10.3892/or.2018.6535
27. Barghi N, Bambaeichi E, Rezaei-Tavirani M, Khaledi N. Aerobic Exercises Induce Antioxidant Pathways Activation in Rats. Int J Prev Med. 2020;11:144. doi: 10.4103/ijpvm.IJPVM_246_19 pmid: 33088472
28. Rocco-Machado N, Cosentino-Gomes D, Meyer-Fernandes JR. Modulation of Na+/K+ ATPase Activity by Hydrogen Peroxide Generated through Heme in L. amazonensis. PLoS One. 2015;10(6):e0129604. doi: 10.1371/journal.pone.0129604 pmid: 26070143
29. Ghanbari-Niaki A, Kraemer RR, Abednazari H. Time-course alterations of plasma and soleus agouti-related peptide and relationship to ATP, glycogen, cortisol, and insulin concentrations following treadmill training programs in male rats. Horm Metab Res. 2011;43(2):112-116. doi: 10.1055/s-0030-1267998 pmid: 21104582
30. M J, H MH, S RA. The effect of eight weeks of aerobic training and coriander seed extract on oxidative stress and ATP indices of lung tissue in rats poisoned with hydrogen peroxide. J Torbat Heydariyeh Univ Med Sci. 2022;9(4):48-60. doi: jms.thums.ac.ir/article-1-1046-en.html
31. Broxterman RM, Layec G, Hureau TJ, Morgan DE, Bledsoe AD, Jessop JE, et al. Bioenergetics and ATP Synthesis during Exercise: Role of Group III/IV Muscle Afferents. Med Sci Sports Exerc. 2017;49(12):2404-2413. doi: 10.1249/MSS.0000000000001391 pmid: 28767527
32. Mahleyuddin NN, Moshawih S, Ming LC, Zulkifly HH, Kifli N, Loy MJ, et al. Coriandrum sativum L.: A Review on Ethnopharmacology, Phytochemistry, and Cardiovascular Benefits. Molecules. 2021;27(1). doi: 10.3390/molecules27010209 pmid: 35011441
33. Sahib NG, Anwar F, Gilani AH, Hamid AA, Saari N, Alkharfy KM. Coriander (Coriandrum sativum L.): a potential source of high-value components for functional foods and nutraceuticals--a review. Phytother Res. 2013;27(10):1439-1456. doi: 10.1002/ptr.4897 pmid: 23281145
34. Elmasry S, Ali H, El-Sheikh N, Awad S. Dose-Dependent Effect of Coriander (Coriandrum Sativum L.) and Fennel (Foeniculum Vulgare M.) on Lead Nephrotoxicity in Rats. Int J Res Stud Biosci. 2016;4:36-45. doi: 10.20431/2349-0365.0406006
35. Yeylaghi Ashrafi M, Dabidi Roshan V. Aerobic and Anaerobic Exercise of the Acute and Chronic and the Selected Markers of Oxidative Stress: A Systematic Review in Human and Animal Studies. J Sabzevar Univ Med Sci. 2016;22(Special Issue):1126-1138. doi: jsums.medsab.ac.ir/article_834.html?lang
36. Pourfazeli B, Azamian Jazi A, Faramarzi M, Mortazavi MJ. Effect of regular aerobic exercise on oxidative damage markers of lipids and proteins in rats exposed to radiation emitted by wi-fi router. J Torbat Heydariyeh Univ Med Sci (J Health Chimes). 2017;5(2R0037):11-19. doi: jms.thums.ac.ir/article-1-428-en.html
37. Li K, Zhu X, Wang Y, Zheng S, Dong G. Effect of aerobic exercise intervention on DDT degradation and oxidative stress in rats. Saudi J Biol Sci. 2017;24(3):664-671. doi: 10.1016/j.sjbs.2017.01.040 pmid: 28386194
38. Diaba-Nuhoho P, Ofori EK, Asare-Anane H, Oppong SY, Boamah I, Blackhurst D. Impact of exercise intensity on oxidative stress and selected metabolic markers in young adults in Ghana. BMC Res Notes. 2018;11(1):634. doi: 10.1186/s13104-018-3758-y pmid: 30176917
39. Farhat F, Amerand A, Simon B, Guegueniat N, Moisan C. Gender-dependent differences of mitochondrial function and oxidative stress in rat skeletal muscle at rest and after exercise training. Redox Rep. 2017;22(6):508-514. doi: 10.1080/13510002.2017.1296637 pmid: 28249551
40. Tofas T, Draganidis D, Deli CK, Georgakouli K, Fatouros IG, Jamurtas AZ. Exercise-Induced Regulation of Redox Status in Cardiovascular Diseases: The Role of Exercise Training and Detraining. Antioxidants (Basel). 2019;9(1). doi: 10.3390/antiox9010013 pmid: 31877965
41. Pilch W, Szygula Z, Tyka AK, Palka T, Tyka A, Cison T, et al. Disturbances in pro-oxidant-antioxidant balance after passive body overheating and after exercise in elevated ambient temperatures in athletes and untrained men. PLoS One. 2014;9(1):e85320. doi: 10.1371/journal.pone.0085320 pmid: 24465535
42. Roh HT, So WY. The effects of aerobic exercise training on oxidant-antioxidant balance, neurotrophic factor levels, and blood-brain barrier function in obese and non-obese men. J Sport Health Sci. 2017;6(4):447-453. doi: 10.1016/j.jshs.2016.07.006 pmid: 30356625
43. Shams Z, Azarbayjani MA, Peeri M, Matin Homaee H. The effect of aerobic training and Vitamin Don GPx concentration and PABin lung tissue of rats exposed to Hydrogen Peroxide. Razi J Med Sci. 2020;26(12):156-166. doi: rjms.iums.ac.ir/article-1-5876-en.html
44. He L, He T, Farrar S, Ji L, Liu T, Ma X. Antioxidants Maintain Cellular Redox Homeostasis by Elimination of Reactive Oxygen Species. Cell Physiol Biochem. 2017;44(2):532-553. doi: 10.1159/000485089 pmid: 29145191
45. Wang R, Wang M, Zhou J, Wu D, Ye J, Sun G, et al. Saponins in Chinese Herbal Medicine Exerts Protection in Myocardial Ischemia-Reperfusion Injury: Possible Mechanism and Target Analysis. Front Pharmacol. 2020;11:570867. doi: 10.3389/fphar.2020.570867 pmid: 33597866
نوع مطالعه:
پژوهشي |
موضوع مقاله:
فیزیولوژی



