BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
URL: http://cmja.arakmu.ac.ir/article-1-733-fa.html


 ، احمد عبدی1
، احمد عبدی1 

 ، جواد مهربانی1
، جواد مهربانی1 

 ، علیرضا براری2
، علیرضا براری2 

2- گروه فیزیولوژی ورزشی، دانشکده تربیت بدنی و علوم ورزشی، دانشگاه گیلان، رشت، ایران.
مقدمه
شیوع اضافه وزن و چاقی طی سه دهه اخیر افزایش یافته و به بیش از دو میلیارد نفر در سراسر جهان افزایش رسیده است [1]. نتیجه مطالعهای نشان داد که 51 درصد مردم جهان در سال 2030 چاق خواهند بود [2]. بیماری همهگیر چاقی تأثیر عمدهای بر سلامت عمومی دارد و مشکلات بهداشتی مرتبط با چاقی توسط عوامل محیطی و ژنتیکی تعدیل میشود [3]. اگرچه عوامل ژنتیکی در چاقی نقش دارند، در بیشتر موارد چاقی ناشی از عدم تعادل بین انرژی مصرفی در نتیجه مصرف زیاد مواد غذایی یا کاهش سطح فعالیت بدنی است. بافت چربی سفید (WAT) محل ذخیره چربیهایی است که روزانه از طریق رژیم غذایی دریافت میشود. باوجوداین، اختلال در عملکرد WAT ناشی از چاقی میتواند به تجمع چربی مضر در دیگر بافتها نیز منجر شود که با بیماریهای متابولیکی مرتبط با چاقی همراه است [4]. سلولهای چربی سفید و قهوهای دو نوع سلول چربی متفاوت با عملکردهای متضاد هستند. چربی سفید محل ذخیره انرژی اضافه است، درحالیکه چربی قهوهای باعث افزایش اکسیداسیون اسیدهای چرب و تولید آن به گرما از طریق پروتئین جفتنشده-1 (UCP-1) به میتوکندری شده و درنتیجه باعث کاهش سوبستری برای ذخیره در WAT میشود. علاوهبراین، دو نوع چربی قهوهای با خواص ترموژنز به نام چربی قهوهای کلاسیک و بژ شناسایی شده است [5]. جالب اینکه میزان این دو نوع چربی قهوهای در پاسخ به محرکهای فیزیولوژیکی از قبیل قرار گرفتن در سرما، آیریزین، اگونیست PPARγ یا تحریکات بتا آدرنرژیک [6] و بالا رفتن متابولیسم بدن افزایش یافته و از چاقی ناشی از رژیم غذایی و بیماریهای مرتبط با آن جلوگیری میکند [5]. چاقی با کاهش ترموژنز همراه است. تغییر WAT به بافت چربی قهوهای شامل بیان و فعالکردن ژنهای خاص قهوهایکننده در بافت چربی سفید است [7]. نقش PGC-1α در تبدیل WAT به قهوهای تایید شده است. PGC-1α یک عامل فعالکننده PPARγ است که بسیاری از اثرات بیولوژیکی خود را بر متابولیسم انرژی اعمال میکند [8]. افزایش بیان PGC-1α باعث افزایش FNDC5 شده و این پروتئین بعد از شکستن از غشای سلولی جدا شده و به نام آیریزین در خون ترشح میشود [8]. آیریزین ناشی از PGC-1α باعث بیان پروتئین UCP‐1 شده و محتویات میتوکندری را افزایش میدهد. UCP‐1 یکی از پروتئینهای مهمی است که در تنظیم ترموژنز چربی قهوهای و توانایی تبدیل WAT به بافت چربی قهوهای [8] نقش دارد. UCP-1 در غشای داخلی میتوکندری وجود دارد و باعث افزایش ترموژنز با تأثیر بر میتوکندری میشود. نشان داده شده که موشهای فاقد UCP-1 در معرض چاقی ناشی از کاهش ترموژنز هستند [9]. علاوهبراین نشان داده شده که چاقی ناشی از HFD در حیوانات باعث کاهش PGC-1α عضله اسکلتی میشود [10].
پژوهشگران سعی میکنند از مداخلههایی استفاده کنند که باعث تغییر در این ژنها/پروتئینها و ملکولهای پاییندست آنها میشود. یکی از مداخلههای مورد توجه، تمرین ورزشی است. در این راستا، ژانگ و همکاران (2019) در پژوهشی نشان دادند که هشتهفته تمرین روی تردمیل باعث افزایش بیان PGC-1α عضله اسکلتی موشهای تغذیهشده با HFD میشود [11]. همچنین کانگ و همکاران (2019) نشان دادند که تمرین شنا باعث افزایش بیان PGC-1α در موشهای چاق میشود [12]. هندسچین و اسپگلمن (2008) نیز نشان دادند که سههفته تمرین استقامتی دویدن روی نوارگردان با شدت متوسط در موشهای صحرایی، منجر به افزایش دو برابری در بیان mRNA ژن UCP-1 در بافت چربی احشایی و افزایش 25 برابری در بافت چربی زیرجلدی شکمی میشود [13]. در بخش دیگری از این پژوهش، سههفته تمرین شنا منجر به افزایش 65 برابری در بیان mRNA ژن UCP-1 در بافت چربی شکمی گردید [8]. باوجوداین، برخی مطالعات عدم تغییر [PGC‐1α [14 و حتی کاهش بیان [PGC‐1α [15 و [UCP-1 [17، 16 را به دنبال فعالیت ورزشی نشان دادند. علاوه بر فعالیتهای ورزشی، مطالعات نشان داده که فعالیت بافت چربی قهوهای با ترکیبات مختلف غذایی مانند کپسایسین موجود در فلفل قرمز افزایش مییابد. تحقیقات، اثر ترموژنیک کپسایسین را در حیوانات و انسانها نشان داده است [18]. تنظیم افزایشی در SIRT1 و PGC‐1α با مصرف کپسایسین با بهبود بیان پروتئینهای ترموژنیکUCP‐1 و BMP8b در بافت چربی سفید همراه بود [19]. فان و همکاران (2019) در پژوهشی نشان دادند که ترکیبی از کپسایسین و کپسیتات میتواند با فعال کردن مسیر سیگنالینگ PPARγ/β3-AR در سلولهای چربی سفید 3T3-L1 باعث قهوهای شدن آن شود و به عنوان یک روش درمانی بالقوه برای چاقی باشد. در این پژوهش، میزان بیان UCP-1، PGC-1α، AMPK، SIRT1 و TRPV1 افزایش معنیداری داشت [20]. پانچل و همکاران (2018) بیان کردند که کپسایسین، فرایند قهوهای شدن را از طریق تعدیل کنندههای متابولیک مثل UCP-1، PGC-1α، AMPK و GLP-1 فراهم میکند [21]. باوجوداین، تأثیرات فیزیولوژیکی کپسایسین و سازگاریهای ناشی از فعالیت ورزشی طولانیمدت، اثر همزمان فعالیت ورزشی و گپسایسین بر شاخصهای تغییر فنوتیپ چربی در مدل موشهای چاق کمتر بررسی شده است. بنابراین، این پژوهش در نظر دارد تا به بررسی اثر تمرین هوازی همراه با مصرف کپسایسین بر بیان ژن PGC-1α و UCP-1 بافت چربی احشایی در موشهای مدل چاق بپردازد.
مواد و روشها
این پژوهش از نوع تجربی بوده و همه آزمایشهای مربوط به حیوانات با توجه به سیاستهای مربوط به حمایت از حیوانات (بر اساس خط مشیهای قرارداد هلسینگی) انجام شده و قوانین راهنمای انستیتوی ملی سلامت در نگهداری حیوانات آزمایشگاهی رعایت شده است. حجم نمونه مطالعه حاضر بر اساس نتایج تحقیقات پیشین، در سطح معنیداری 5 درصد (خطای نوع اول) و توان آماری 95% (خطای نوع دوم) و با استفاده از نرمافزار Medcalc 18.2.1 (8 سر در هر گروه) تعیین شد. معیار ورود به مطالعه حاضر شامل سلامت کامل موشها و عدم استفاده از هرگونه دارو بود. معیار خروج از مطالعه، عدم اجرای پروتکل تمرینی و مصرف نکردن مکمل و آسیب حین اجرای تمرین بود. تعداد 40 سر موش صحرایی نر 5 هفتهای با وزن 9/41± 147/68 از نژاد ویستار از انستیتو پاستور تهیه و به آزمایشگاه منتقل شدند. حیوانات مورد آزمایش در قفسهای پلیکربنات نگهداری شدند. دمای محیط 1/4±22 درجه سانتیگراد و چرخه روشنایی به تاریکی 12:12 ساعت و رطوبت 4±55/6 درصد بود. تمامی حیوانات به آب و غذای ویژه موش دسترسی آزاد داشتند.
روش القای چاقی
بعد از سازگاری موشها با شرایط محیطی جدید (پس از یک هفته)، موشها به دو گروه رژیم غذایی نرمال (8=n، ND) و رژیم غذایی پرچرب (32=n، HFD) تقسیم شدند. موشهای گروه ND به مدت هشتهفته با غذایی استاندارد (23 درصد پروتئین، 65 درصد کربوهیدرات و 12 درصد چربی) تغذیه شدند. در همین مدت، موشهای گروه HFD از رژیم غذایی پرچرب استفاده کردند. غذای پرچرب شامل 17 درصد پروتئین، 43 درصد کربوهیدرات و 40 درصد چربی بود [23]. چاق شدن موشها با شاخص لی ارزیابی شد. موشهایی با مقادیر بالای 310 بر اساس شاخص لی، چاق محسوب شدند. بعد از هشتهفته، همه موشها به 5 گروه: رژیم غذایی نرمال (ND)، پرچرب (HFD)، پرچرب-تمرین (HFDT)، پرچرب-کپسایسین (HFDCap) و پرچرب-تمرین- کپسایسین (HFDTCap) تقسیم شدند. در ادامه پژوهش، رژیم غذایی پرچرب به رژیم غذایی استاندارد تغییر یافت.
پروتکل تمرینی
قبل از شروع تمرین اصلی و به منظور آشنایی با چگونگی فعالیت توسط تردمیل، موشها در یک هفته طی پنج جلسه، به مدت پنج دقیقه با سرعت 10-8 متر بر دقیقه با شیب صفر فعالیت داشتند. برنامه فعالیت بدنی هوازی شامل دویدن روی تردمیل با شیب صفر درصد به مدت هشتهفته و پنج روز در هفته بود. در هفته اول، موشها یک برنامه تمرینی هوازی فزاینده را روی تردمیل با شدت 15 متر در دقیقه به مدت 30 دقیقه انجام دادند. بعد از آن، شدت فعالیت از 15 متر در دقیقه به 25 متر در دقیقه در هفته هفتم رسید و زمان فعالیت نیز به 60 دقیقه افزایش یافت (جدول شماره 1).

با توجه به منبع استفادهشده، این شدت تمرین معادل 60-50 درصد VO2max در موشهای چاق بود [23]. به منظور تحریک موشها برای دویدن، از محرک صوتی (ضربه به دیواره نوارگردان)، استفاده شد؛ بدین صورت که در جلسات اول، از محرّک الکتریکی با ولتاژ کم، همراه با محرّک صوتی استفاده شد و پس از شرطی کردن موشها به همراه بودن دو محرّک، در سایر جلسات به منظور رعایت نکات اخلاقی کار با حیوان آزمایشگاهی، فقط از محرّک صوتی استفاده شد.
نحوه تهیه و مصرف
کپسایسین (با خلوص 95 درصد) از شرکت سیگما-آلدریچ خریداری شد. محلول کپسایسین (mg/ml 4) در سالین 0/9 درصد آماده شد. کپسایسین در سالین به خوبی حل نمیشود، اما سوسپانسیون به دست میآید. در تمام موارد قبل از استفاده از محلول برای اطمینان از اینکه ترکیبات در حالت معلق وجود دارد، به شدت مخلوط میشد. این ترکیب به صورت خوراکی با گاواژ یک بار در روز با دوز mg/kg/day 4 به مدت هشتهفته در صبح پس از شروع چرخه روشنایی استفاده میشد [24]. به دیگر گروهها نیز به همان میزان سالین گاواژ شد.
روش نمونهگیری از بافت چربی و اندازهگیری متغیرها
پس از اعمال متغیر مستقل، تمام نمونهها با شرایط کاملاً مشابه و در شرایط پایه (48 ساعت پس از آخرین جلسه تمرینی و 12 تا 14 ساعت ناشتایی) با تزریق داخل صفاقی ترکیبی از کتامین (mg/kg 60) و زایلازین (mg/kg 5) بیهوش شدند. بافت مورد نظر بلافاصله پس از جداسازی، وزنکشی و شستوشو با سالین فوراً در تیوبهای حاوی RNA later برای جلوگیری از تخریبRNA قرار داده شد و به نیتروژن مایع منتقل و سپس در یخچال در دمای 80- درجه سانتیگراد تا زمان اندازهگیری نگهداری شد. برای جلوگیری از تأثیر ریتم شبانهروزی، نمونهگیری از ساعت 8 آغاز میشد و در ساعت 11:30 دقیقه به پایان میرسید. برای بررسی بیان PGC-1α و UCP-1 در هر گروه از تکنیک PCR Real Time استفاده شد.
روش اندازهگیری بیان PGC-1α و UCP-1
استخراج RNA
20 میلیگرم از بافت با استفاده از اسکالپر خرد و وارد میکروتیوپ شده، سپس RNA به روش تریزول استخراج شد. به منظور اطمینان از غلظت مناسب RNA استخراجشده، جذب نمونهها با استفاده از دستگاه نانودراپ (ND-1000 NANODROP 385 spectrophotometer) خوانده شد. همچنین کیفیت RNA استخراجشده توسط الکتروفروز روی ژل آگارز بررسی شد. سنجش کمی برای تعیین غلظت RNA به روش اسپکتوفتومتری انجام شد.
سنتز cDNA
سنتز cDNA طبق دستورالعمل موجود در کیت (K1621) تهیه شد. واکنش رونویسی معکوس با استفاده از آنزیم RevertAid™M-MuLV Reverse transcriptase صورت گرفت. هنگام تهیه cDNA از نمونه تخلیصشده پس از قرائت جذب، حجمی شامل 1000 نانوگرم RNA برداشته، سپس 0.5µL Random Hexamers، 0.5µL پرایمر oligodT (الیگودئوکسی ریبو نوکلئوتید) به آن افزوده و تا حجم 12 میکرولیتر آب DEPC اضافه و به دمای 65 درجه به مدت 5 دقیقه منتقل شد. در ادامه، به مدت 2 دقیقه روی یخ قرار گرفت. در مرحله بعد، 4µL 5X Reaction Buffer و 2µL dNTP و 1µL RiboLock RNase Inhibitor و1µL RevertAid RT به این ترکیب اضافه شد و به مدت 5 دقیقه در دمای 25 و بعد از آن به مدت 60 دقیقه در دمای 42 قرار گرفت. در آخر به منظور از کار افتادن آنزیم RT، تیوبهای واکنش به مدت 5 دقیقه در دمای 70 درجه سانتیگراد قرار گرفت. cDNA آمادهشده برای انجام Real time-PCR به کار رفت.
طراحی، آمادهسازی پرایمر
تمام پرایمرها توسط نرمافزار Allele IDv7.8 طراحی شد و از ژن β2m (بتا 2 میکروگلوبولین) به عنوان کنترل داخلی استفاده گردید (جدول شماره 2).

تمام پرایمرها به صورت اتصال اگزون- اگزون طراحی شد و برای اطمینان از عدم تکثیر DNA ژنومی از 25 نانوگرم cDNA و 25 نانوگرم RNA در تیوبهای جداگانه از واکنش PCR و ژل آگاروز 1/5% استفاده شد.
انجام Real time-PCR
برای اندازهگیری mRNA، 1 میکروگرم از کل RNA بافتی با آنزیم (RQ1 RNAse-free DNAse-I (Promega و (retro-transcribed (RT تیمار شد. واکنش Real-time PCR با استفاده از دستگاه SYBR Green qPCR Master Mix انجام شد. پروتکل چرخه حرارتی مورد استفاده Real time-PCR شامل °95 به مدت 10 دقیقه و به دنبال آن 40 سیکل °15 ثانیهای در حرارت °95، 55 ثانیه در°60 و 5 ثانیه در دمای °72 بود. سپس در دمای °72 درجه سانتیگراد به مدت 10 دقیقه نگهداری شد.
تحلیل آماری
پس از تأیید توزیع نرمال دادهها با استفاده از آزمون شاپیرو ویلک و همگنی واریانسها توسط از آزمون لون، برای تجزیهوتحلیل آماری از آزمون آنالیز واریانس یکطرفه و آزمون تعقیبی توکی استفاده شد. محاسبات با استفاده از نرمافزار آماری spss نسخۀ 21 انجام شد و سطح معنیداری آزمونها P≤0/05 در نظر گرفته شد.
یافتهها
در جدول شماره 3 میانگین و نتایج آزمون بین گروهی مربوط به متغیرهای پژوهش در گروههای مختلف ارائه شده است.

تجزیهوتحلیل دادهها نشان داد که تفاوت معنیداری در میزان تغییرات بیان PGC-1α بافت چربی احشایی بین گروههای مختلف وجود دارد (F= 31/317 , P=0/000) (جدول شماره 3). نتایج آزمون تعقیبی نشان داد بین گروههای HFDبا ND با (P=0/000) و HFDT با (P=0/018) و HFDCaP با (P=0/021) تفاوت معنیداری وجود دارد. همچنین بین گروههای HFD با گروههای HFDT با (P=0/032) و HFDCaP با (P= 0/028) و HFDTCaP با (P=0/000) و HFDTCaP با گروههای HFDT با (P=0/040) و HFDCaP با (P=0/047)اختلاف معنیداری مشاهده شد (جدول شماره 3، نمودار شماره 1).
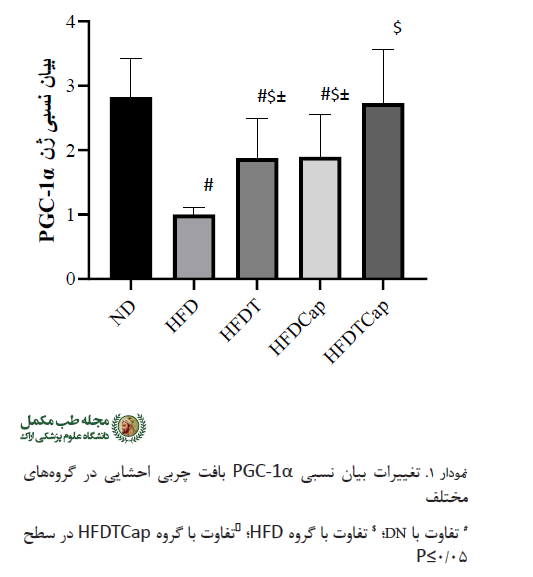
تجزیهوتحلیل دادهها نشان داد که تفاوت معنیداری در میزان تغییرات بیان UCP-1 بافت چربی احشایی بین گروههای مختلف وجود دارد (000/0P=، 337/28F=) (جدول شماره 3). نتایج آزمون تعقیبی نشان داد که بین گروههای ND با HFD با (P=0/000) و ObeT با (P=0/000) و HFDCaP با (P=0/000) و تفاوت معنیداری وجود دارد. همچنین بین گروههای HFD با گروههای HFDT با (P=0/005) و HFDCaP با (P=0/049) و HFDTCaP با (P=0/000)؛ و گروه HFDTCaP با گروههای HFDT با (P=0/017) و HFDCaP با (P=0/001) اختلاف معنیداری مشاهده شد (جدول شماره 3، نمودار شماره 2).

بحث
در پژوهش حاضر نشان داده شد که HFD باعث کاهش معنیدار بیان PGC-1α و UCP-1 بافت چربی احشایی شده است. در این راستا، کنون و همکارن (2020) نشان دادند که HFD باعث کاهش بیان UCP-1 و آیریزین بافت چربی احشایی و PGC-1α عضله اسکلتی موشهای چاق میشود [25]. گلیفورد و همکاران (2017) نیز بیان کردند که HFD باعث کاهش بیان PGC-1α و UCP-1 بافت چربی اپیدرمال میشود [16]. UCP-1 مولکولهای اصلی ترموژنز بوده و نقش مهمی در قهوهای کردن WAT دارد [26]. PGC-1α رونویسی UCP-1 را در WAT افزایش داده و باعث تمایز آن به سمت چربی قهوهای میشود [27].
برخی مطالعات نشان دادهاند که کاهش UCP1 باعث افزایش ابتلا به چاقی میشود [28] و میزان آن با چاقی و میزان انرژی دریافتی مرتبط است [29]. به نظر میرسد که اختلال در متابولیسم در نتیجه مصرف رژیم غذایی پر چرب باعث باعث کاهش بیان PGC-1α و UCP-1 بافت چربی احشایی شده است. در تأیید این نتایج، کیم و همکاران (2017) کاهش بیان PGC-1α و UCP-1 بافت چربی زیرجلدی [30] و سانسه و همکاران (2019) کاهش بیان UCP-1 را در بافت چربی [31] موشهای HFD نشان دادند. کاهش در UCP-1 ممکن است ناشی از افزایش بیان میوستاتین در عضلات اسکلتی باشد که باعث فسفوریلاسیون و فعالسازی SMAD3 در افراد چاق میشود. نقش SMAD3، مهار تولید آیریزین است. در عضلات اسکلتی، SMAD3 به پروموتور ژن FNDC5 و Ppargc1a متصل شده و بیان این ژنها را سرکوب میکند [32]. بااینحال، در پژوهش حاضر، هشتهفته تمرین فزاینده توانست تأثیر منفی چاقی بر بیان PGC-1α و UCP-1 را جبران کند. همراستا با این پژوهش، زیگلر و همکاران (2019) در پژوهشی نشان دادند که هر دو نوع تمرین هوازی و مقاومتی باعث افزایش در میزان بیان PGC-1α و UCP-1 بافت چربی احشایی در موشها میشود [33].
مطالعات دیگری نیز نشان دادند که PGC-1α به دنبال تمرینات استقامتی طولانیمدت [16]، تمرینات ترکیبی [34] و حاد استقامتی [8] افزایش مییابد. باوجوداین، گلیفورد و همکاران (2017) نشان دادند که تمرین روی چرخ دوار تأثیر معنیداری بر PGC-1α عضله اسکلتی و بافت چربی اپیدرمال موشهای تغذیهشده با رژیم پرچرب ندارد [15]. علاوهبراین، برخی مطالعات نشان دادند که فعالیت ورزشی باعث کاهش اثرات ترموژنیک در بافت چربی قهوهای میشود [35، 17، 16]. شش تا هشتهفته دویدن روی تردمیل با شدت متوسط باعث کاهش بیان UCP-1 بافت چربی قهوهای و توده کل بافت چربی قهوهای شد [17، 16]. به نظر میرسد که آزمودنیهای درگیر در فرایند پژوهش و خصوصیات آنها، نوع و شدت تمرین و حتی محیط تمرین بر نتایج تأثیرگذار باشد.
مکانیسمهای مختلفی برای افزایش بیان PGC-1α در نتیجه فعالیت ورزشی و تمرین بیان کردهاند. افزایش در سطوح اپینفرین به عنوان یک مکانیسم قوی در این رابطه گزارش شده است [36]. علاوهبراین تمرینات استقامتی با استفاده از مسیرهای وابسته به کلسیم و فسفات، آنزیمهای کیناز وابسته به آدنوزین منوفسفات و کالمودلین را فعال و درنتیجه منجر به فعالسازی PGC-1α میشود. همچنین فعالیت هوازی باعث کاهش شارژ انرژی درون سلولی و به دنبال آن فعالسازی AMPK و فعال کردن PGC-1α درون هسته برای تأثیر بر افزایش بیان ژنهای درگیر در بیوژنز میتوکندری و حتی افزایش PGC-1α میشود [37].
در پژوهش حاضر، افزایش PGC-1α به دنبال فعالیت ورزشی هوازی در موشهای HFD با افزایش بیان UCP-1 همراه بود. در مطالعه کیانمهر و همکارن (2020) نیز افزایش بیان PGC-1α و UCP-1 به دنبال تمرین روی تردمیل مشاهده شد [38]. مطالعات قبلی نشان داده است که تمرین ورزشی باعث افزایش UCP-1 بافت WAT میشود [40 ،39]. علاوهبراین هو و همکاران (2014) بیان کردند که فعالیت ورزشی طولانیمدت در موشها باعث افزایش UCP-1 و قهوهای شدن بافت چربی زیرجلدی میشود، اما، HFD باعث کاهش این اثرات میشود [16]. آیریزین میتواند بیان UCP-1 را در سلولهای چربی در شرایط in vivo و داخل بدن تنظیم کرده و منجر به افزایش چربی قهوهای شود [8]. با توجه به ارتباط معنیداری که بین بیان UCP-1 و آیریزین وجود دارد [41]، به نظر میسد که بخشی از اثر تمرین بر بیان UCP-1 چربی احشایی از مسیر آیریزین باشد. علاوهبراین نشان داده شده که بیان UCP-1 میتواند مستقل از آیریزین افزایش پیدا کند. گزارش شده که تمرین ورزشی باعث افزایش بیان PGC-1α میشود [36] و این عامل محرک بیان UCP-1 است [42].
در پژوهش حاضر، افزایش بیان PGC-1α با افزایش بیان UCP-1 همراستا بود. طی فعالیتهای ورزشی، PGC-1α فعال شده و به نوبه خود باعث رهایش آیریزین به گردش خون میشود و درنهایت بر سایر بافتها تأثیر میگذارد که یکی از اثرات آن قهوهای کردن WAT از طریق UCP-1 است [43، 8].
از دیگر نتایج پژوهش حاضر، افزایش بیان PGC-1α و UCP-1 بافت چربی احشایی در موشهای HFD بعد از مصرف کپسایسین بود. جالب اینکه مطالعات اخیر نشان میدهد برخی ترکیبات فعال زیستی ازجمله ترکیبات فنولی، بیان آیریزین را در عضلات اسکلتی [34] و میوبلاستهای WAT, L6 و [45 ،44] تحریک میکند. به نظر میرسد در این پژوهش کپسایسین با افزایش PGC-1α و UCP-1 مسیر FNDC5/آیریزین را در موشهای چاق فعال میکند. یافتههای مطالعه حاضر مطابق با یافتههایی است که نشان میدهد کپسایسین قادر به افزایش بیان PGC-1α میباشد [19]. علاوهبراین کپسایسین قادر به افزایش چندین ژن گرمازا متابولیکی، از جملهUCP-1، BMP8b، SIRT1، PGC-1α و PRDM-16 است [46]. یکی دیگر از اثرات کپسایسین، فعال کردن PPARα و PPARγ است، درحالیکه HFD باعث سرکوب PPARα میشود [19].
محرکهای مختلفی توانایی قهوهای کردن WAT را دارند که شامل درمانهای دارویی، فعالیت ورزشی و آگونیستهای PPARγ هستند [47]. همه این محرکها توانایی فعال کردن گیرندههای بتا آدرنرژیک را دارند. علاوهبراین، احتمال دارد ترکیبات موجود در کپسایسین، قهوهای کردن WAT را از طریق مکانیسمهای مختلفی ازجمله فعالسازی گیرندههای بتا آدرنرژیک وساطت کنند. با وجوداین در مطالعهای نشان داده شد که کپسایسین تأثیری بر پروتئینهای ترموژنیک و قهوهایکننده بافت چربی اپیدرمال (BMP8b و UCP-1) در موشهایی با رژیم غذایی نرمال ندارد [19]. همچنین در مطالعهای نشان داده شد که کپسایسین تأثیر معنیداری بر سطوح پایه UCP-1 ندارد [48]. بههرحال مطالعات بیشتری برای درک بهتر مکانیسم قهوهای شدن WAT از طریق کپسایسین ضروری است. مشابه یافتههای مطالعه حاضر، نشان داده شد که عصاره تمشک و سایر ترکیبات فنولی مانند رزوراترول و کوئرستین باعث القای قهوهای شدن WAT و کوچک شدن اندازه چربی در موشهای چاق میشود [45 ،43].
لونزی و همکاران (2020) نیز نشان دادند که عصاره انگور نیز به دلیل داشتن ترکیبات فنولی باعث فعال شدن مسیر FNDC5/آیریزین شده و همچنین این عصاره میتواند اثرات فعالیت ورزشی را از این مسیر تقلید کند [49]. در پژوهش حاضر، اثر افزایشی ترکیب تمرین و کپسایسین بر بیان PGC-1α و UCP-1 بیشتر از اثر هر کدام بهتنهایی بود. به نظر میرسد تمرین هوازی و کپسایسین با تأثیر بر مسیر سیگنالینگ SIRT1/AMPK/ PGC-1α باعث افزایش آیریزین شده و به نوبه خود باعث افزایش بیان UCP-1 در بافت چربی احشایی و درنتیجه باعث تغییر WAT به بافت چربی قهوهای میشود. درنهایت میتواند تا حدی بیماریهای وابسته به چاقی را کنترل کند. مداخلات ورزشی و ترکیبات فیتوشیمیایی از طریق تغییر در مقدار و نوع چربی بافت چربی در موشهای چاق باعث بهبود اختلالات متابولیکی شوند [50]. SIRT1، IL-6، AMPK و محرکهای مؤثر بر گیرندههای آدرنرژیکی نیز میتواند از طریق فعالیت ورزشی و کپسایسین بر شاخصهای تعدیلکننده WAT به قهوهای تأثیر داشته باشد، اما به دلیل هزینه زیاد، اندازهگیری نشد. همچنین بررسی هیستولوژی توزیع WAT و قهوهای در نتیجه تمرین و کپسایسین، میتواند درک بهتری برای اثرات این دو نشان دهد. توصیه میشود در پژوهشهای بعدی به این دو محدودیت نیز توجه شود.
نتیجهگیری
به طور خلاصه، تمرین ورزشی و کپسایسین باعث تأثیر بر مسیر قهوهای شدن بافت چربی احشایی در موشها شده که بخشی از این اثرات، ناشی از افزایش در بیان GC-1α و UCP-1 است. بنابراین، استفاده از کپسایسین و دیگر ترکیبات زیستی فعال به همراه فعالیت بدنی هوازی یک استراتژی جالب و مؤثر برای خنثی کردن رژیمهای غذایی پر چرب است. مطالعات انسانی برای بررسی اثر کپسایسین و فعالیت ورزشی بر این مسیر ضروری به نظر میرسد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این پژوهش با توجه به سیاستهای مربوط به حمایت از حیوانات (بر اساس خط مشیهای قرارداد هلسینگی) و با تأیید کمیته اخلاق در پژوهش پژوهشگاه تربیت بدنی و علوم ورزشی با کد IR.SSRC.REC.1398.125 انجام شده است.
حامی مالی
این مقاله حاصل پایاننامه دکتری نویسنده اول با شماره دانشجویی 940537057 در گروه فیزیولوژی ورزشی، دانشکده تربیت بدنی و علوم ورزشی، دانشگاه آزاد اسلامی واحد آیتالله آملی است.
مشارکت نویسندگان
همه نویسندگان در همه بخشها به یک اندازه مشارکت داشتهاند.
تعارض منافع
نویسندگان مقاله هیچگونه تعارضی در منافع اعلام نکردند.
تشکر و قدردانی
نویسندگان بدینوسیله، تشکر و قدردانی خود را از دانشگاه آزاد اسلامی واحد آیتالله آملی اعلام میدارند.
References
1.Ng M, Fleming T, Robinson M, Thomson B, Graetz N, Margono C, et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013: A systematic analysis for the global burden of disease study 2013. The Lancet. 2014; 384(9945):766-81. [DOI:10.1016/S0140-6736(14)60460-8]
2.Finkelstein EA, Khavjou OA, Thompson H, Trogdon JG, Pan L, Sherry B, et al. Obesity and severe obesity forecasts through 2030. American Journal of Preventive Medicine. 2012; 42(6):563-70. [DOI:10.1016/j.amepre.2011.10.026] [PMID]
3.Yaghoobpour Yekani O, Azarbayjani MA, Peeri M, Farzanegi P. [Effect of type of training on markers of hepatocyte apoptosis in rats fed with high fat diet (Persian)]. Yafte. 2018; 19(5):106-16. http://yafte.lums.ac.ir/article-1-2540-fa.html
4.Gonçalves IO, Passos E, Rocha-Rodrigues S, Torrella JR, Rizo D, Santos-Alves E, et al. Physical exercise antagonizes clinical and anatomical features characterizing Lieber-DeCarli diet-induced obesity and related metabolic disorders. Clinical Nutrition. 2015; 34(2):241-7. [DOI:10.1016/j.clnu.2014.03.010] [PMID]
5.Harms M, Seale P. Brown and beige fat: Development, function and therapeutic potential. Nature Medicine. 2013; 19(10):1252-63. [DOI:10.1038/nm.3361] [PMID]
6.Morton TL, Galior K, McGrath C, Wu X, Uzer G, Uzer GB, et al. Exercise increases and browns muscle lipid in high-fat diet-fed mice. Frontiers in Endocrinology. 2016; 7:80. [DOI:10.3389/fendo.2016.00080] [PMID] [PMCID]
7.Servera M, López N, Serra F, Palou A. Expression of “brown-in-white” adipocyte biomarkers shows gender differences and the influence of early dietary exposure. Genes & Nutrition. 2014; 9(1):372. [DOI:10.1007/s12263-013-0372-4] [PMID] [PMCID]
8.Boström P, Wu J, Jedrychowski MP, Korde A, Ye L, Lo JC, et al. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature. 2012; 481(7382):463-8. [DOI:10.1038/nature10777] [PMID] [PMCID]
9.Denjean F, Lachuer J, Géloën A, Cohen-Adad F, Moulin C, Barré H, et al. Differential regulation of uncoupling protein‐1,‐2 and ‐3 gene expression by sympathetic innervation in brown adipose tissue of thermoneutral or cold‐exposed rats. FEBS Letters. 1999; 444(2-3):181-5. [DOI:10.1016/S0014-5793(99)00056-3]
10.Kazeminasab F, Marandi SM, Ghaedi K, Safaeinejad Z, Esfarjani F, Nasr-Esfahani MH. A comparative study on the effects of high-fat diet and endurance training on the PGC-1α-FNDC5/irisin pathway in obese and nonobese male C57BL/6 mice. Applied Physiology, Nutrition, and Metabolism. 2018; 43(7):651-62. [DOI:10.1139/apnm-2017-0614] [PMID]
11.Zhang YJ, Li J, Huang W, Mo GY, Wang LH, Zhuo Y, et al. [Effect of electroacupuncture combined with treadmill exercise on body weight and expression of PGC-1α, Irisin and AMPK in skeletal muscle of diet-induced obesity rats (Chinese)]. Zhen Ci Yan Jiu. 2019; 44(7):476-80. [PMID] [DOI:10.13702/j.1000-0607.180460]
12.Kang YS, Kim JC, Kim JS, Kim SH. Effects of swimming exercise on serum Irisin and bone FNDC5 in rat models of high-fat diet-induced osteoporosis. Journal of Sports Science & Medicine. 2019; 18(4):596-603. [PMID] [PMCID]
13.Handschin C, Spiegelman BM. The role of exercise and PGC1α in inflammation and chronic disease. Nature. 2008; 454(7203):463-9. [DOI:10.1038/nature07206] [PMID] [PMCID]
14.Norheim F, Langleite TM, Hjorth M, Holen T, Kielland A, Stadheim HK, et al. The effects of acute and chronic exercise on PGC‐1α, Irisin and browning of subcutaneous adipose tissue in humans. FEBS Journal. 2014; 281(3):739-49. [DOI:10.1111/febs.12619] [PMID]
15.Guilford BL, Parson JC, Grote CW, Vick SN, Ryals JM, Wright DE. Increased FNDC5 is associated with insulin resistance in high fat‐fed mice. Physiological Reports. 2017; 5(13):e13319. [DOI:10.14814/phy2.13319] [PMID] [PMCID]
16.Wu MV, Bikopoulos G, Hung S, Ceddia RB. Thermogenic capacity is antagonistically regulated in classical brown and white subcutaneous fat depots by high fat diet and endurance training in rats’ impact on whole-body energy expenditure. The Journal of Biological Chemistry. 2014; 289(49):34129-40. [DOI:10.1074/jbc.M114.591008] [PMID] [PMCID]
17.De Matteis R, Lucertini F, Guescini M, Polidori E, Zeppa S, Stocchi V, et al. Exercise as a new physiological stimulus for brown adipose tissue activity. Nutrition, Metabolism & Cardiovascular Diseases. 2013; 23(6):582-90. [DOI:10.1016/j.numecd.2012.01.013] [PMID]
18.Yoneshiro T, Saito M. Transient receptor potential activated brown fat thermogenesis as a target of food ingredients for obesity management. Current Opinion in Clinical Nutrition and Metabolic Care. 2013; 16(6):625-31. [DOI:10.1097/MCO.0b013e3283653ee1] [PMID]
19.Baskaran P, Krishnan V, Ren J, Thyagarajan B. Capsaicin induces browning of white adipose tissue and counters obesity by activating TRPV1 channel‐dependent mechanisms. British Journal of Pharmacology. 2016; 173(15):2369-89. [DOI:10.1111/bph.13514] [PMID] [PMCID]
20.Fan L, Xu H, Yang R, Zang Y, Chen J, Qin H. Combination of capsaicin and capsiate induces browning in 3T3-L1 white adipocytes via activation of the peroxisome proliferator-activated receptor γ/β3-adrenergic receptor signaling pathways. Journal of Agricultural and Food Chemistry. 2019; 67(22):6232-40. [DOI:10.1021/acs.jafc.9b02191] [PMID]
21.Panchal SK, Bliss E, Brown L. Capsaicin in metabolic syndrome. Nutrients. 2018; 10(5):630. [DOI:10.3390/nu10050630] [PMID] [PMCID]
22.Jamali E, Asad MR, Rassouli A. [Effect of eight-week endurance exercise on resistin gene expression in visceral adipose tissues in obese rats (Persian)]. Journal of Shahid Sadoughi University of Medical Sciences. 2017; 25(1):20-31. http://jssu.ssu.ac.ir/article-1-3559-en.html
23.Rocha-Rodrigues S, Rodríguez A, Gouveia AM, Gonçalves IO, Becerril S, Ramírez B, et al. Effects of physical exercise on myokines expression and brown adipose-like phenotype modulation in rats fed a high-fat diet. Life Sciences. 2016; 165:100-8. [DOI:10.1016/j.lfs.2016.09.023] [PMID]
24.Mosqueda-Solís A, Sánchez J, Portillo MP, Palou A, Picó C. Combination of capsaicin and hesperidin reduces the effectiveness of each compound to decrease the adipocyte size and to induce browning features in adipose tissue of western diet fed rats. Journal of Agricultural and Food Chemistry. 2018; 66(37):9679-89. [DOI:10.1021/acs.jafc.8b02611] [PMID]
25.Kwon J, Kim B, Lee C, Joung H, Kim BK, Choi IS, et al. Comprehensive amelioration of high-fat diet-induced metabolic dysfunctions through activation of the PGC-1α pathway by probiotics treatment in mice. PLoS One. 2020; 15(2):e0228932. [DOI:10.1371/journal.pone.0228932] [PMID] [PMCID]
26.Lin J, Handschin C, Spiegelman BM. Metabolic control through the PGC-1 family of transcription coactivators. Cell Metabolism. 2005; 1(6):361-70. [DOI:10.1016/j.cmet.2005.05.004] [PMID]
27.Puigserver P, Wu Z, Park CW, Graves R, Wright M, Spiegelman BM. A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis. Cell. 1998; 92(6):829-39. [DOI:10.1016/S0092-8674(00)81410-5]
28.Winn NC, Vieira-Potter VJ, Gastecki ML, Welly RJ, Scroggins RJ, Zidon TM, et al. Loss of UCP1 exacerbates western diet-induced glycemic dysregulation independent of changes in body weight in female mice. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 2017; 312(1):R74-R84. [DOI:10.1152/ajpregu.00425.2016] [PMID] [PMCID]
29.von Essen G, Lindsund E, Cannon B, Nedergaard J. Adaptive facultative diet-induced thermogenesis in wild-type but not in UCP1-ablated mice. American Journal of Physiology-Endocrinology and Metabolism. 2017; 313(5):E515-E27. [DOI:10.1152/ajpendo.00097.2017] [PMID]
30.Kim E, Lim SM, Kim MS, Yoo SH, Kim Y. Phyllodulcin, a natural sweetener, regulates obesity-related metabolic changes and fat browning-related genes of subcutaneous white adipose tissue in high-fat diet-induced obese mice. Nutrients. 2017; 9(10):1049. [DOI:10.3390/nu9101049] [PMID] [PMCID]
31.Senese R, Cioffi F, De Matteis R, Petito G, de Lange P, Silvestri E, et al. 3,5 Diiodo-L-Thyronine (T2) promotes the browning of white adipose tissue in high-fat diet-induced overweight male rats housed at thermoneutrality. Cells. 2019; 8(3):256. [DOI:10.3390/cells8030256] [PMID] [PMCID]
32.Perakakis N, Triantafyllou GA, Fernández-Real JM, Huh JY, Park KH, Seufert J, et al. Physiology and role of irisin in glucose homeostasis. Nature Reviews Endocrinology. 2017; 13(6):324-37. [DOI:10.1038/nrendo.2016.221] [PMID] [PMCID]
33.Ziegler AK, Damgaard A, Mackey AL, Schjerling P, Magnusson P, Olesen AT, et al. An anti-inflammatory phenotype in visceral adipose tissue of old lean mice, augmented by exercise. Scientific Reports. 2019; 9(1):12069. [DOI:10.1038/s41598-019-48587-2] [PMID] [PMCID]
34.Abdi A, Mehrabani J, Nordvall M, Wong A, Fallah A, Bagheri R. Effects of concurrent training on irisin and fibronectin type-IIi Domain Containing 5 (FNDC5) expression in visceral adipose tissue in type-2 diabetic rats. Archives of Physiology and Biochemistry. 2020; January:1-6. [DOI:10.1080/13813455.2020.1716018] [PMID]
35.Rachel Richards M, Harp JD, Ory DS, Schaffer JE. Fatty acid transport protein 1 and long-chain acyl coenzyme A synthetase 1 interact in adipocytes. Journal of Lipid Research. 2006; 47(3):665-72. [DOI:10.1194/jlr.M500514-JLR200] [PMID]
36.Sutherland LN, Bomhof MR, Capozzi LC, Basaraba SAU, Wright DC. Exercise and adrenaline increase PGC‐1α mRNA expression in rat adipose tissue. Journal of Physiology. 2009; 587(7):1607-17. [DOI:10.1113/jphysiol.2008.165464] [PMID] [PMCID]
37.Roberts-Wilson TK, Reddy RN, Bailey JL, Zheng B, Ordas R, Gooch JL, et al. Calcineurin signaling and PGC-1α expression are suppressed during muscle atrophy due to diabetes. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 2010; 1803(8):960-7. [DOI:10.1016/j.bbamcr.2010.03.019] [PMID] [PMCID]
38.Kianmehr P, Azarbayjani MA, Peeri M, Farzanegi P. Synergic effects of exercise training and octopamine on peroxisome proliferator-activated receptor-gamma coactivator-1a and uncoupling protein 1 mRNA in heart tissue of rat treated with deep frying oil. Biochemistry and Biophysics Reports. 2020; 22:100735. [DOI:10.1016/j.bbrep.2020.100735] [PMID] [PMCID]
39.Roca-Rivada A, Castelao C, Senin LL, Landrove MO, Baltar J, Crujeiras AB, et al. FNDC5/irisin is not only a myokine but also an adipokine. PLoS One. 2013; 8(4):e60563. [DOI:10.1371/journal.pone.0060563] [PMID] [PMCID]
40.Claycombe KJ, Vomhof-DeKrey EE, Roemmich JN, Rhen T, Ghribi O. Maternal low-protein diet causes body weight loss in male, neonate Sprague-Dawley rats involving UCP-1-mediated thermogenesis. The Journal of Nutritional Biochemistry. 2015; 26(7):729-35. [DOI:10.1016/j.jnutbio.2015.01.008] [PMID]
41.Ghaderi M, Mohebbi H, Soltani B. [The effect of 14 weeks of endurance training with two different Intensity on serum irisin level, gene expression of skeletal muscle PGC1-α and FNDC5 and subcutaneous adipose tissue UCP1 in obese rats (Persian)]. Medical Journal of Tabriz University of Medical Sciences and Health Services. 2019; 41(1):72-81. https://mj.tbzmed.ac.ir/fa/Article/26047
42.Luisa Bonet M, Oliver P, Palou A. Pharmacological and nutritional agents promoting browning of white adipose tissue. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 2013; 1831(5):969-85. [DOI:10.1016/j.bbalip.2012.12.002] [PMID]
43.Xing T, Kang Y, Xu X, Wang B, Du M, Zhu MJ. Raspberry supplementation improves insulin signaling and promotes brown‐like adipocyte development in white adipose tissue of obese mice. Molecular Nutrition & Food Research. 2018; 62(5):1701035. [DOI:10.1002/mnfr.201701035] [PMID]
44.Palacios-González B, Vargas-Castillo A, Velázquez-Villegas LA, Vasquez-Reyes S, López P, Noriega LG, et al. Genistein increases the thermogenic program of subcutaneous WAT and increases energy expenditure in mice. The Journal of Nutritional Biochemistry. 2019; 68:59-68. [DOI:10.1016/j.jnutbio.2019.03.012] [PMID]
45.Andrade JMO, Barcala-Jorge AS, Batista-Jorge GC, Paraíso AF, de Freitas KM, de Farias Lelis D, et al. Effect of resveratrol on expression of genes involved thermogenesis in mice and humans. Biomedicine & Pharmacotherapy. 2019; 112:108634. [DOI:10.1016/j.biopha.2019.108634] [PMID]
46.Baskaran P, Krishnan V, Fettel K, Gao P, Zhu Z, Ren J, et al. TRPV1 activation counters diet-induced obesity through sirtuin-1 activation and PRDM-16 deacetylation in brown adipose tissue. International Journal of Obesity. 2017; 41(5):739-49. [DOI:10.1038/ijo.2017.16] [PMID] [PMCID]
47.Kim SH, Plutzky J. Brown fat and browning for the treatment of obesity and related metabolic disorders. Diabetes & Metabolism Journal. 2016; 40(1):12-21. [DOI:10.4093/dmj.2016.40.1.12] [PMID] [PMCID]
48.Kida R, Yoshida H, Murakami M, Shirai M, Hashimoto O, Kawada T, et al. Direct action of capsaicin in brown adipogenesis and activation of brown adipocytes. Cell Biochemistry & Function. 2016; 34(1):34-41. [DOI:10.1002/cbf.3162] [PMID]
49.Lanzi CR, Perdicaro DJ, Tudela JG, Muscia V, Fontana AR, Oteiza PI, et al. Grape pomace extract supplementation activates FNDC5/irisin in muscle and promotes white adipose browning in rats fed a high-fat diet. Food & Function. 2020; 11(2):1537-46. [DOI:10.1039/C9FO02463H] [PMID]
50.Kong LC, Wuillemin PH, Bastard JP, Sokolovska N, Gougis S, Fellahi S, et al. Insulin resistance and inflammation predict kinetic body weight changes in response to dietary weight loss and maintenance in overweight and obese subjects by using a Bayesian network approach. The American Journal of Clinical Nutrition. 2013; 98(6):1385-94. [DOI:10.3945/ajcn.113.058099] [PMID]
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





