مقدمه
به کار بردن فراوردههای مواد طبیعی در پیشگیری و درمان بیماریها سابقهای معادل طول عمر بشر دارد. با وجود پیشرفتهای شگرف در تولید داروهای شیمیایی، نهتنها از اهمیت گیاهان دارویی کاسته نشده، بلکه به دلیل بهتر پذیرفته شدن توسط افراد بیمار، از دیدگاه اقتصادی به صرفه بودن، عوارض جانبی کمتر، امکان تولید آنها در سطح وسیع در کشور و قابلیت بازیافت، کاربردهای آنها افزایش یافته است. این گیاهان مضراتی، ازجمله خطر مصرف خودسرانه، پیچیدگی در استانداردسازی و-عدم درمان سریع بیماری نیز دارند [
1].
سازمان بهداشت جهانی مهمترین و بهترین منبع برای تولید انواع داروها را گیاهان دارویی میداند [
2] و طبق آمار، حدود 80 درصد از جمعیت جهان از فرآوردههای طبیعی استفاده میکنند [
3]. فرایندهای توسعه دارو طبق استاندارهایی که سازمان غذا و داروی آمریکا تعریف کرده است از پنج مرحله تشکیل شده که در تحقیقات پیش بالینی (مرحله دوم)، بررسی سمیت و اندازهگیری دُز درمانی روی حیوانات آزمایشگاهی انجام میپذیرد [
4].
یکی از ترکیبات طبیعی که اثرات آن در دهه اخیر در زمینه طب سنتی بررسی شده، گرده گل زنبور عسل است [
5]. گرده گل، دانههای ریزی است که در قسمت انتهایی پرچم گل قرار دارد و تنها عامل برای بارور کردن گیاه است [
6]. زنبور عسل برای تأمین نیازهای پروتئینی و ویتامینی خود و نوزادانش، آن را به صورت ساچمه، روی پاهای عقب، درون کیسههای مخصوص، ذخیره کرده و به درون کندو میبرد. در مناطقی که گرده گل به وفور یافت میشود، پرورشدهندگان با نصب تله گردهگیر جلوی راه پرواز زنبور، آن را جمعآوری و خشک میکنند [
7].
این گرده در واقع مجموعهای از ذرات گرده گلها است که با ترکیب شهد مکیده شده و بزاق زنبور عسل به هم پیوسته به صورت یک ماده یکنواخت در میآید. بر اساس تحقیقات انجامشده گرده گل زنبور عسل در تمام مراحل رشد زنبورها به عنوان یک ماده غذایی در کندو استفاده میشود [
8]. گرده گل زنبور عسل حاوی کربوهیدرات، فیبر، لیپید، آمینواسیدهای ضروری بدن و ترکیبات فلاونوئیدی مانند مایریستین است [
9]. این گرده به نوع گیاهی که توسط زنبور عسل از آنها برداشته میشود، آب و هوا و نوع خاک منطقه بستگی دارد [
10, 11].
محققین برای تعیین اثرات دارویی گرده روی بعضی از بیماریها مطالعاتی انجام دادهاند. به عنوان یک تقویتکننده عمومی برای درمان بعضی از بیماریها در تعدادی از کلینیکها و بیمارستانهای اروپا و آسیای شرقی استفاده شده است [
12].گرده گل در بهبود بیماریهای عصبی نیز مؤثر بوده و مصرف حدود یک هفته از این ماده باعث افزایش امید به زندگی و بهبود علائم افسردگی در بیماران شده است [
13].
اثر ضدالتهاب گرده زنبور عسل به دلیل وجود فلاونوئید، فنولیکاسید، فیتواسترول و موادی همچون آنتول است [
14]. به نظر میرسد گرده گل زنبور عسل عمدتاً به علت فنولیک اسیدهایی همچون وانیلیک، پروتوکاتچیک، گالیک، پکوماریک اسید و فلاونوئیدهایی مانند هسپریدین، روتین، کامپفرول، آپیجنین، لوتئولین، کوئرستین و ایزورامنتین فعالیت آنتیاکسیدانی قوی دارد. این ترکیبات، ماده الکتروفیل را غیرفعال و رادیکالهای آزاد و گونههای فعال اکسیژن را پاکسازی میکنند [
15].
قابلیت حذف تورم ایجادشده از آسیبهای قلبی-عروقی و کلیوی، حفاظت از کبد در برابر آسیب ناشی از تتراکلریدکربن و کاهش التهاب و بزرگی پروستات را ازجمله ویژگیهای خاص این ماده برشمردند. اثر مثبت بر پروستات را همچنین به عمل آنتیآندروژن گرده زنبور عسل نسبت میدهند [
16].
یکی از استفادههای درمانی گرده گل زنبور عسل مهار فرایند لیپید پراکسیداسیون پس از استفاده از داروهای شیمی درمانی است. توهامی و همکاران به مطالعه اثر حفاظتی گرده گل در برابر سیس پلاتین پرداختند و دریافتند که با وجود آسیبهای ناشی از استرس اکسیداتیو القاشده توسط سیس پلاتین در اندامهای کبد، کلیه و بیضه و ایجاد آسیب بافتی در اندامهای ذکرشده، گرده گل زنبور عسل با اثرات آنتیاکسیدانی این عوارض را به شدت کاهش میدهد [
17]. مصرف گرده یا عصارههای آن تأثیر آنتیاکسیدانی قویای دارد و از کبد و روده کوچک در برابر آسیبهای ناشی از برخی سموم محافظت میکند [
18].
ساربک و همکاران اثر آنتیاکسیدانی هفت نوع ترکیب فنلی گردههای گل ایسلندی جمعآوریشده توسط زنبور عسل را بررسی کردند و نتایج نشان داد که قرصهای حاوی گردههای گل باعث کاهش شاخص اسید تیوباربیتوریک و فعالیت آنزیمهای اکسیدکننده در کبد و مغز موش شد [
19].
این ماده در مطالعات قبلی آثار فارماکولوژیک متعددی درخصوص بهبود حافظه، اثرات ضد اضطرابی، خواص ضدتشنجی و بهبود زخم معده در یک روز مصرف و با دُزهای متعدد داشته است؛ بنابراین در این مطالعه با نگاه به مطالعات گذشته [
20, 21, 22]، دُز مؤثر انتخاب و انجام شده است. از طرفی به دلیل عدم وجود مطالعاتی درخصوص اثر سمیت گرده گل زنبور عسل بر سلامت یا ارگانهای بدن، به نظر میرسد مطالعات سمشناسی روی گرده گل زنبور عسل ضروری و حائز اهمیت باشد. پس مقرر شد در این مطالعه بررسی ایمنی گرده گل زنبور عسل بر عملکرد، استرس اکسیداتیو و تغییرات هیستوپاتولوژی کبد، کلیه و پانکراس موش صحرایی انجام شود.
مواد و روشها
روش عصارهگیری
در این مطالعه جهت عصارهگیری گرده گل زنبور عسل (از شرکت معتبر عسل باران باغرو در شهر اردبیل)، از روش خیساندن استفاده شد [
23].
مدل حیوانی
در این تحقیق از چهارده سر موش صحرایی نر بالغ از نژاد اسپراگ داولی در محدوده وزنی 250-200 گرم از خانه حیوانات دانشگاه علومپزشکی جندیشاپور اهواز تهیه شد. حیوانات در اتاق حیوانات دانشکده داروسازی در قفسهای استاندارد با سیکل نوری دوازده ساعت تاریکی و دوازده ساعت روشنایی و میزان دمای 2±23 درجه سانتیگراد و در رطوبت 50 تا 70 درصد نگهداری شدند. حیوانات در طول نگهداری و مطالعه از غذاهای فشرده مخصوص حیوان و آب لولهکشی شهر استفاده کردند. حیوانات قبل از جراحی با کتامین و زایلازین بیهوش شدند.-
چهارده سر موش صحرایی به صورت تصادفی در دو گروه هفتتایی تقسیم شدند که به شرح زیر است:
گروه اول: موشهای دریافتکننده عصاره هیدروالکلی گرده گل زنبور عسل با دُز 800 میلیگرم بر کیلوگرم به صورت درون صفاقی و به صورت تک دُز (گروه درمانی) [
22, 23].
گروه دوم: موشهای دریافتکننده نرمال سالین با دُز 100 گرم بر 0/5 میلیگرم به صورت درون صفاقی به صورت تک دُز (گروه کنترل).
یک روز بعد از تزریق عصاره، موشها ابتدا وزن شده، سپس با تزریق درون صفاقی کتامین با دُز 95 میلیگرم بر کیلوگرم و زایلازین با دُز 5 میلیگرم بر کیلوگرم بیهوش شده و بلافاصله مستقیماً از قلب آنها خونگیری انجام شد. نمونههای خونی حیوانات برای بررسی نیتروژن اوره خون و کراتینین آلفا ، آمیلاز، آسپارتات آمینوتراسفراز و آلانین آمینوترانسفراز به آزمایشگاه منتقل شدند. بعد از آن، وزن ارگانهای کبد، کلیه و پانکراس نیز ثبت شد و جهت بررسی آزمایشات بافتشناسی و هیستوپاتولوژی تکهای از بافتهای کبد، کلیه و پانکراس در محلول فرمالین 10 درصد قرار داده شد و به آزمایشگاه منتقل شد و تکهای از بافتهای مذکور هم جهت اندازهگیری بیومارکرهای بافتی مالوندیآلدئید و گلوتاتیون احیا برداشته و تا هنگام آزمایش در دمای 70 درجه سانتیگراد نگهداری شدند.
محاسبه درصد ایندکس وزنی بافت
برای محاسبه درصد ایندکس وزنی بافت، وزن اولیه موش و وزن بافتهای موش پس از آسانکشی اندازهگیری شد و از طریق فرمول زیر محاسبه شد:
100 × (وزن اولیه موش/وزن بافت)=درصد ایندکس وزنی بافت
تستهای سرمی
از نمونه سرم جهت انجام آزمایشات آلانین آمینوترانسفراز، آسپارتات آمینوتراسفراز، نیتروژن اوره خون، کراتینین و کراتینین آلفا (ساخت شرکت پارس آزمون ایران) با دستگاه اتوآنالایزر BT-3000 ساخت ایتالیا استفاده شد.
هموژن کردن بافتها
بافتها به نسبت 10 درصد وزنی-حجمی با بافر فسفات (آماده خریداریشده از شرکت اید زیست) با دستگاه هموژنایزر، میکس و سپس در دور دوازده هزار به مدت سی دقیقه سانتریفیوژ شدند و محلول سوپرناتانت (محلول رویی ناشی از سانتریفیوژ) جهت تستهای گلوتاتیون و مالوندیآلدئید جدا شد.
اندازهگیری مالوندیآلدئید
این بیومارکر به منظور سنجش استرس اکسیداتیو طبق روش گفتهشده انجام شد. به 0/5 میلیلیتر محلول سوپرناتانت، 0/5 میلیلیتر اسید تری کلرواستیک (از شرکت مرک آلمان) 70 درصد اضافه شد و به مدت پانزده دقیقه در دور سه هزار سانتریفوژ شد. سپس 0/5 میلیلیتر از مایع رویی جدا شده و 0/5 میلیلیتر تیو باربیتوریک اسید (از شرکت مرک آلمان) 0/8 درصد به آن اضافه شد و به مدت سی دقیقه در بنماری در حال جوش قرار داده شد و پس از آن به مدت ده دقیقه در آب سرد قرار داده شد. سپس در طول موج 532 نانومتر توسط دستگاه اسپکتروفوتومتر جذب آن قرائت شد و مقدار مالوندیآلدئید بافتی بر اساس میکرومول بر گرم بافت گزارش شد [
24].
اندازهگیری میزان گلوتاتیون احیا
محتوای گلوتاتیون بافتی توسط واکنش گلوتاتیون با معرف المن-(از شرکت سیگمای آمریکا) و ایجاد رنگ زرد اندازهگیری شد [
25]. بهطور خلاصه چهل میکرولیتر محلول سوپرناتانت به دو میلیلیتر بافر فسفات (از شرکت Bio-Idea) اضافه و مخلوط شد. سپس چهل میکرولیتر معرف المن اضافه شد و رنگ زرد ایجادشده در طول موج 412 نانومتر با دستگاه اسپکتروفتومتر مدل SPEKOL 2000 ساخت کشور کره قرائت و نتایج به صورت میمول بر گرم بافت گزارش شد [
24].
بررسی هیستوپاتولوژی
بعد از خونگیری ابتدا موشها آسانکشی شده و سپس بافتهای کبد، کلیه و پانکراس جدا شده و در فرمالین 10 درصد فیکس شدند. بعد از فیکس کردن با الکل، بخشها دهیدراته و در پارافین پارافینه شدند. بلوکهای پارافین با ضخامت µm6-4-برش داده شدند و رنگآمیزی هماتوکسیلین-ائوزین انجام و برای آنالیز با میکروسکوپ نوری آماده شدند [
26].
روشهای آماری
آنالیز آماری با از نرمافزارSPSS-نسخه22-انجام شد. برای هر گروه از موشها، میانگین سطح متغیر به صورت میانگین±انحراف معیار محاسبه و برای مقایسه میانگینها از آزمون تی مستقل در محدوده P<0/05 استفاده شد. نمودارها با نرمافزار گرافپد Prism 8 XML Project-و میکروسافت اکسل 2016 ترسیم شد.
یافتهها
نتایج وزن
درصد ایندکس وزنی بافتهای کبد، کلیه و پانکراس محاسبه شده و مشاهده شد اختلاف معناداری بین گروه دریافتکننده عصاره هیدروالکلی گرده گل زنبور عسل و گروه کنترل از لحاظ وزنی وجود ندارد (
تصویر شماره 1).
.jpg)
بیومارکرهای سرمی و بافتی
کبد:
میزان آلانین آمینوترانسفراز سرم در گروه دریافتکننده عصاره نسبت به گروه کنترل کاهش داشت، اما این کاهش از نظر آماری معنادار نبود. (
تصویر شماره 2-الف).
اما میزان آسپارتات آمینوتراسفراز سرم در گروه دریافتکننده عصاره نسبت به گروه کنترل کاهش داشت که این کاهش از نظر آماری نیز معنادار بود (
تصویر شماره 2-ب).
بیومارکرهای بافتی در کبد شامل مالوندیآلدئید و گلوتاتیون-(
تصویر شماره 2-ج و 2-د) در گروه کنترل و گروه دریافتکننده عصاره با تک دُز 800 میلیگرم بر کیلوگرم به صورت درونصفاقی بررسی و مشخص شد که بین دو گروه از نظر آماری اختلاف معناداری وجود ندارد (
تصویر شماره 2).
کلیه
سطح سرمی نیتروژن اوره خون در گروه دریافتکننده عصاره نسبت به گروه کنترل کاهش یافت که این تغییر از نظر آماری معنادار بود (P<0/05) (
تصویر شماره 3-الف).
.jpg)
میزان کراتین سرم در گروه دریافتکننده عصاره هیدروالکلی گرده گل زنبور عسل نسبت به گروه کنترل افزایش داشت، اما این افزایش ازنظر آماری معنادار نبود (
تصویر شماره 3-ب).
بیومارکر بافتی مالوندیآلدئید کلیه در گروه دریافتکننده عصاره هیدروالکلی گرده گل زنبورعسل با تک دُز 800 میلیگرم بر کیلوگرم-نسبت به گروه کنترل کاهش داشت و این کاهش بین دو گروه از نظر آماری معناداری بود (P<0/05) (
تصویر شماره 3- ج).
بیومارکر بافتی گلوتاتیون (
تصویر شماره 3-د) کلیه در گروه دریافتکننده عصاره هیدروالکلی گرده گل زنبورعسل با تک دُز 800 میلیگرم بر کیلوگرم نسبت به گروه کنترل با افزایش معناداری همراه بود (P<0/05) (
تصویر شماره 3-د).
پانکراس
سطح سرمی آلفا آمیلاز در گروه دریافتکننده عصاره هیدروالکلی گرده گل زنبور عسل با تک دُز 800 میلیگرم بر کیلوگرم به صورت درون صفاقی در مقایسه با گروه کنترل اختلاف معناداری نداشت (P>0/05) (
تصویر شماره 4-الف).

همچنین سطح بیومارکرهای بافتی شامل گلوتاتیون (
تصویر شماره 4-ج) و مالوندیآلدئید (
تصویر شماره 4-ب) در گروه کنترل و گروه دریافتکننده عصاره هیدروالکلی گرده گل زنبور عسل با تک دُز 800 میلیگرم بر کیلوگرم به صورت درون صفاقی و پس از 24 ساعت بررسی و مشخص شد که بین دو گروه از نظر آماری در تستهای مالوندیآلدئید و گلوتاتیون اختلاف معناداری وجود ندارد (P>0/05) (
تصویر شماره 4-الف).
هیستوپاتولوژی
در مطالعات هیستوپاتولوژی بافتها مشخص شد که بین گروه کنترل و گروه دریافتکننده عصاره هیدروالکلی گرده گل زنبور عسل در تمام بافتهای کبد، کلیه و پانکراس تفاوت آنچنانی وجود ندارد و عملاً همه بافتها سالم و هیچگونه آسیبی ناشی از عصاره مشاهده نشد (
تصویر شماره 5).
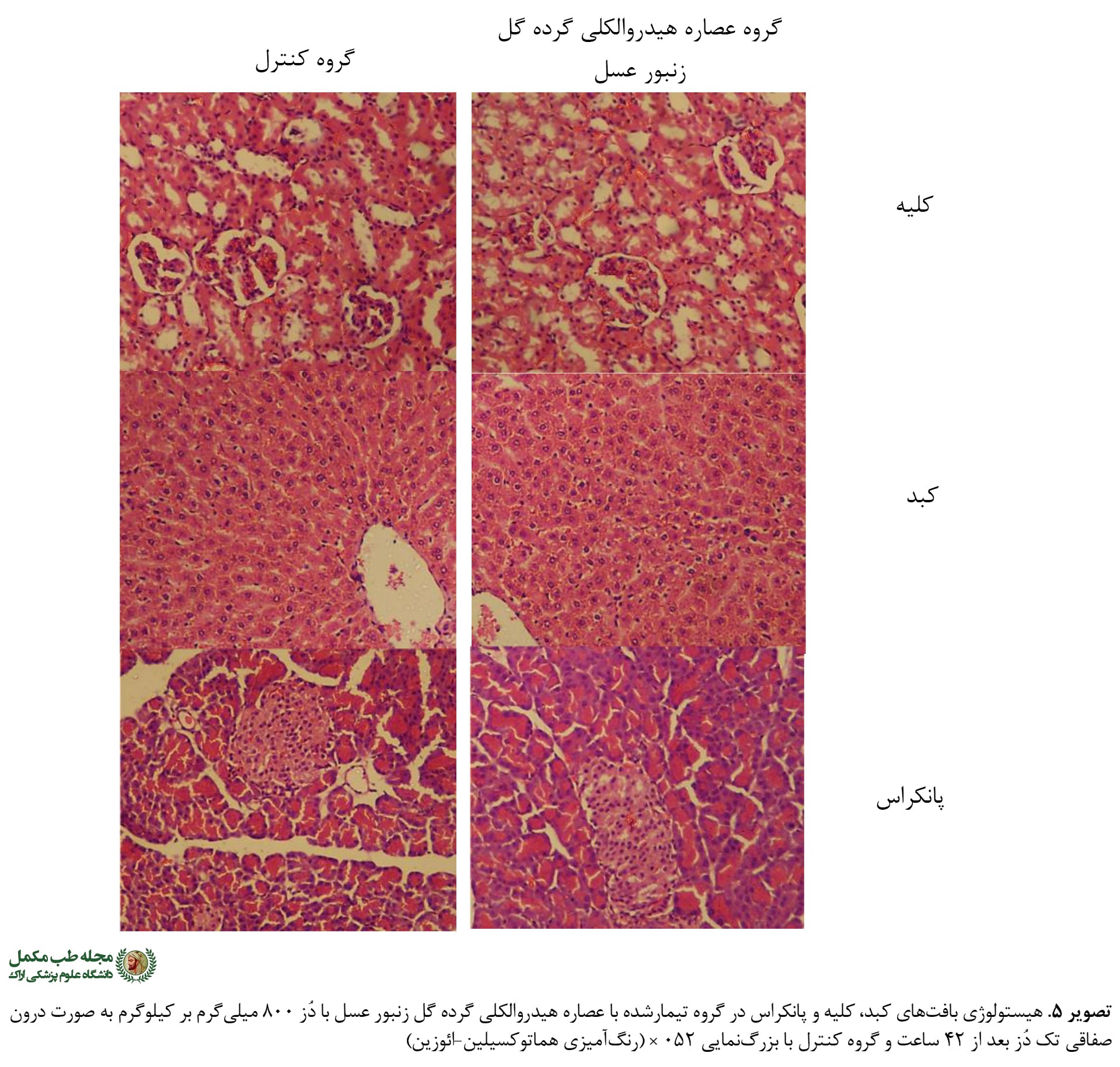
در نمونههای بافتی تهیهشده، احتقان گلبولهای قرمز، ارتشاح سلولهای التهابی و پیکنوز هستهای به عنوان شاخصهای آسیب بافتی ارزیابی شد و تفاوت معناداری بین گروههای کنترل و گروه دریافتکننده عصاره هیدروالکلی گرده گل زنبور عسل مشاهده نشد.
بحث
قبل از استفاده دارویی از گیاهان، میبایست از سلامت آنها اطمینان کسب کرد. یک راه کلیدی اطمینان از سلامت داروها انجام تستهای سمیت در مدل حیوانی مناسب است [
1].
در این مطالعه، مرگومیر و تغییری در رفتار تغذیهای بین موشهای هر دو گروه کنترل و دریافتکننده عصاره هیدروالکلی گرده گل زنبور عسل مشاهده نشد. درصد ایندکس وزنی بافتهای جداشده در پایان مطالعه نیز بیانگر عدم تغییر معناداری بین بافتهای دو گروه کنترل و عصاره بود. در این مطالعه، وزن ارگانهای داخلی به صورت درصد ایندکس وزنی بافت، ارزیابی شد و نتایج بیانگر عدم سمیت گرده گل روی بافتهای مورد مطالعه بود.
در این مطالعه، بیومارکرهای کلیوی (کراتین و نیتروژن اوره خون) بررسی شد. اندازهگیری و بررسی آنزیم نیتروژن اوره خون در گروه دریافتکننده عصاره در مقایسه با گروه کنترل به صورت معناداری کاهش یافت، ولی آنزیم کراتین هیج تغییر معناداری در آن مشاهده نشد. در مطالعهای که توسط هوآنگ و همکاران صورت گرفت نیز به بررسی اثر محافظتی گرده گل در برابر اثرات توکسیک سیس پلاتین پرداخته شد و مشاهده شد که گرده باعث کاهش معنادار سطح سرمی نیتروژن اوره خون در مقایسه با گروه کنترل میشود که حاکی از نقش محافظتی و آنتیاکسیدانی گرده گل است [
27].
در شرایط استرس اکسیداتیو، رادیکالهای آزاد تولیدشده بیش از مقدار آنتیاکسیدانهای موجود در بدن است که توسط انواع آنتیاکسیدانها مانند گلوتاتیون تا حدودی مهار میشود. رادیکالهای آزاد در بدن باعث لیپید پراکسیداسیون، آسیب دیانای، اکسیداسیون پروتئین و تخریب فسفولیپیدها در غشای سلولی میشوند. محصول نهایی لیپید پراکسیداسیون مالوندیآلدئید است که میتواند مقیاس خوبی برای محاسبه سرعت لیپید پراکسیداسیون باشد [
28].
میزان مالوندیآلدئید بافت کلیه اندازهگیری و مشاهده شد که میزان مالوندیآلدئید بافت کلیه در گروه دریافتکننده عصاره هیدروالکلی گرده گل زنبور عسل نسبت به گروه کنترل کاهش معناداری داشته و میزان گلوتاتیون بافتی که یک عامل آنتیاکسیدانی است، در بافت کلیه در گروه دریافتکننده عصاره-نسبت به گروه کنترل افزایش داشته است.
در این راستا، اراسلان و همکاران بررسی شد که در آن مطالعه به بررسی نقش گرده گل روی ماده مخرب و سمی پروپکسور پرداختند و مشاهده شد که گرده گل سبب کاهش آسیب بافت کلیوی ناشی از مواجهه با این سم میشود و همچنین باعث-کاهش میزان مالوندیآلدئید و افزایش سطح گلوتاتیون این بافت به علت نقش آنتیاکسیدانی گرده گل میشود [
29]. در مطالعه دیگری توسط این محقق و همکارانش که به بررسی اثرات بهبوددهنده و محافظتی گرده گل روی ماده سمی کارباریل پرداختند و به نتایج مشابهی در این زمینه دست یافتند [
30].
آنا ساریک همکاران، ام. لِجا همکاران در مطالعاتی جداگانه اثرات و ویژگیهای گرده گل زنبور عسل در موش سفید کوچک را بررسی کرده و به این نتیجه رسیدند که همه گونههای گرده گل دارای مقدار قابل توجهی ترکیباتی فنولی و ویتامین C (آسکوربات) با ویژگیهای آنتیاکسیدانی هستند که میتواند تأثیر بسزایی در محافظت و سلامت ارگانهای مختلف داشته باشد [
31 ،
19].
در این مطالعه، بیومارکرهای کبدی (آسپارتات آمینوتراسفراز و آلانین آمینوترانسفراز) سنجیده شد و میزان آنزیم آلانین آمینوترانسفراز از لحاظ آماری در دو گروه مطالعه اختلاف معناداری نداشت، ولی آنزیم آسپارتات آمینوتراسفراز در گروه عصاره به صورت معناداری (P<0/05) کاهش یافته بود.
ترانس آمینازها (آسپارتات آمینوتراسفراز و آلانین آمینوترانسفراز)، آنزیمهای شناختهشدهای هستند که به عنوان بیومارکرهای پیشبینی احتمالی سمیت کبدی استفاده میشوند. به طور کلی آسیب به سلولهای پارانشیمال کبدی منجر به بالا رفتن این ترانس آمینازها میشود [
32]. مطالعه حاضر نشان میدهد که مصرف عصاره هیدروالکلی گرده گل زنبور عسل با دُز 800 میلیگرم بر کیلوگرم به مدت یک روز، نهتنها اثر مخربی روی هپاتوسیتهای کبدی نداشته، بلکه با کاهش آسپارتات آمینوتراسفراز میتواند در درمان مشکلات کبدی نقش مؤثری داشته باشد و بررسی مطالعات گذشته نیز آثار محافظتی و عدم سمیت کبدی این ماده را تأیید میکند [
20].
در بررسیهای مختلف آنتیاکسیدانهای موجود در عصاره هیدروالکلی گرده گل زنبور عسل را به عنوان ماده مؤثر در فعالیت محافظتی کبد معرفی کردهاند [
29 ،
27].
بیومارکرهای بافتی کبد (مالوندیآلدئید و گلوتاتیون( در گروه کنترل و گروه دریافتکننده عصاره هیدروالکلی گرده گل بررسی و مشخص شد که بین دو گروه از نظر آماری اختلاف معناداری وجود ندارد. در همین راستا، آل دایهان و همکاران نیز نشان دادند که گرده گل زنبور عسل میتواند در مقابل سدیم فلوراید با اثر هپاتونفروتوکسیسیتی نقش حفاظتی از خود نشان دهد [
33].
در بیومارکر پانکراس (آلفا آمیلاز) و بیومارکرهای بافتی (مالوندیآلدئید و گلوتاتیون) آن بین دو گروه عصاره و گروه کنترل از نظر آماری اختلاف معناداری مشاهده نشد که این حاکی از عدم نقش مضر و آسیبزننده این ماده به بافت پانکراس است.
بررسیهای هیستوپاتولوژیکی بافتهای کبد، کلیه و پانکراس در این مطالعه نیز نشان میدهد که تفاوت معناداری بین بافتهای بررسیشده در گروه دریافتکننده عصاره هیدروالکلی گرده گل زنبور عسل و گروه کنترل وجود ندارد و اثرات سمی در بافتهای مورد بررسی مشاهده نشد.
نتیجهگیری
در کشور ما این ماده باارزش جایگاه خود را در صنایع دارویی و غذایی بهطور کامل به دست نیاورده است؛ بنابراین لازم است با بررسی ویژگیها، کاربرد و قابلیتهای آنها به عنوان یک افزودنی طبیعی و سلامتبخش و جلوگیریکننده از بسیاری از بیماریها، توجه بسیاری از متخصصان در صنایع داروسازی، غـذایی و زنبـورداری به این ماده ارزشمند معطوف شود.
گرده گل زنبور عسل خواص درمانی بسیاری دارد و میتواند به عنوان یک ماده مغذی و درمانی برای انسان استفاده شود. با اینکه مطالعات انسانی در این زمینه بسیار محدود است، اما نتایج امیدوارکنندهای در مطالعات حیوانی مشاهده شده است. به هر حال، پیش از استفاده درمانی از این محصول طبیعی زنبور عسل، بررسیهای سمیت و اثبات ایمنی آن امری ضروری است.
با توجه به نتایج حاصل از بررسی بیومارکرهای بافتی (مالوندیآلدئید و گلوتاتیون) و مارکرهای سرمی مرتبط با بافتهای بررسیشده (نیتروژن اوره خون، کراتینین، آلفا آمیلاز آسپارتات آمینوتراسفراز و آلانین آمینوترانسفراز) و مطالعات هیستوپاتولوژی، تزریق درونصفاقی با دُز 800 میلیگرم بر کیلوگرم به صورت تک دُز گرده گل زنبور عسل پس از 24 ساعت، نهتنها اثر سمیتی روی اندامهای کبد، کلیه و پانکراس موشهای صحرایی ایجاد نکرد، بلکه در مواردی توانست باعث حفاظت در بافت مورد نظر شود.
با اینکه نتایج بهدستآمده در این مطالعه گامی در جهت رد سمیت گرده گل در دُزهای مؤثر درمانی روی کبد، کلیه و پانکراس موشهای صحرایی بود، اما تحقیقات بیشتری برای اثبات ایمنی این ماده ارزشمند نیاز است و جهت اطمینان از اثرات سودمند گرده گل، نیاز به مطالعات گسترده و طبق قوانین و ضوابط موجود روی مدل انسانی است. از طرف دیگر، با بهکارگیری این مواد زیست فعال باارزش، گامی به سوی حفـظ سـلامت جامعـه و جلـوگیری از بسـیاری از بیماریها برداشته شود.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه نتیجه پایاننامه دکترای حرفهای داروسازی محمد جواد باقری است. هزینه این پایاننامه از محل اعتبار طرح تحقیقاتی مصوب شماره B-97055 دانشگاه علومپزشکی جندیشاپور اهواز و با کد اخلاق IRAJUMS.ABHC.REC.1397.049 پرداخت شده است.
حامی مالی
هزینههای این مطالعه از محل اعتبار طرح تحقیقاتی مصوب شماره B-97055 دانشگاه علومپزشکی جندیشاپور اهواز تأمین شده است.
مشارکت نویسندگان
کار با حیوان و رعایت اخلاق در کار با حیوان و نظارت: ندا سیستانی؛ انجام کارهای آزمایشگاهی: محمدجواد باقری؛ تستهای پاتولوژی: لعیاسادات خرسندی؛ کار با دستگاههای آزمایشگاه: زینب دهقان محمدی؛ طراحی مطالعه، نظارت بر پروژه، آنالیز دادهها و نوشتن درفت اولیه مقاله: مریم سله چه.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
References
1.Baradaran A. Administration of herbal drugs in geriatric individuals; trends on its helps and hazards. Geriatrics Persia. 2017; 1(1):e01.
2.Yadav R, Agarwala M. Phytochemical analysis of some medicinal plants. Journal of Phytology. 2011; 3(12):10-4. https://updatepublishing.com/journal/index.php/jp/article/view/2737
3.Maiti B, Nagori B, Singh R. Recent trends in herbal drugs: A review. International Journal of Drug Research and Technology. 2011; 1(1):17-25. https://www.ijdrt.com/articles/recent-trends-in-herbal-drugsa-review.pdf
4.Disch L, Drewe J,Fricker G. Dissolution Testing of herbal medicines: Challenges and regulatory standards in Europe, the United States, Canada, and Asia. Dissolution Technologies. 2017; 24(2):6-12. [DOI:10.14227/DT240217P6]
5.Muntha P. Drug discovery & development-A review. Research and Reviews: Journal of Pharmacy and Pharmaceutical Sciences. 2016; 5(1):135-42. https://www.rroij.com/open-access/drug-discovery--development--a-review-.php?aid=78654
6.Pascoal A, Rodriguse S, Teixeira A, Fea’s X, Estevinho LM. Biological activities of commercial bee pollens: Antimicrobial, antimutagenic, antioxidant and anti-inflammatory. Food and Chemical Toxicology. 2014; 63:233-9 [DOI:10.1016/j.fct.2013.11.010] [PMID]
7.Medeiros KC, Figueiredo CA, Figueredo TB, Freire KR, Santos FA, Alcantara-Neves NM, et al. Anti-allergic effect of bee pollen phenolic extract and myricetin in ovalbumin-sensitized mice. Journal of Ethnopharmacology. 2008; 119(1):41-6. [DOI:10.1016/j.jep.2008.05.036] [PMID]
8.Abdella EM, Tohamy A, Ahmad RR. Antimutagenic activity of Egyptian propolis and bee pollen water extracts against cisplatin-induced chromosomal abnormalities in bone marrow cells of mice. Iranian Journal of Cancer Prevention. 2009; 2(4):175-81. https://www.sid.ir/en/Journal/ViewPaper.aspx?ID=167583
9.Fatrcová-Šramková K, Nôžková J, Kačániová M, Máriássyová M, Rovná K, Stričík M. Antioxidant and antimicrobial properties of monofloral bee pollen. Journal of Environmental Science and Health. 2013; 48(2):133-8.-[PMID]
10.Morais M, Moreira L, Feás X, Estevinho LM. Honeybee-collected pollen from five Portuguese Natural Parks: Palynological origin, phenolic content, antioxidant properties and antimicrobial activity. Food and Chemical Toxicology. 2011; 49(5):1096-101. [DOI:10.1016/j.fct.2011.01.020] [PMID]
11.Viuda-Martos M, Ruiz-Navajas Y, Fernández-López J, Pérez-Alvarez JA.. Functional properties of honey, propolis, and royal jelly. Journal of Food Science. 2008; 73(9):R117-24. [DOI:10.1111/j.1750-3841.2008.00966.x] [PMID]
12.Almedia-Muradian LB, Pamplona LC, Coimbra S, Barth OM. Chemical composition and botanical evaluation of dried bee plellets. Journal of food composition and analysis. 2005; 18(1):105-11. [DOI:10.1016/j.jfca.2003.10.008]
13.Silva BM, Andrade PB, Valentão P, Ferreres F, Seabra RM, Ferreira MA.-Quince (Cydoniaoblonga Miller) fruit (pulp, peel, and seed) and jam: Antioxidant activity. Journal of Agricultural and Food Chemistry. 2004; 52(15):4705-12. [DOI:10.1021/jf040057v] [PMID]
14.Choi EM. Antinociceptive and antiinflammatory activities of pine (Pinus densiflora) pollen extract. Phytotherapy Research. 2007; 21(5):471-5. [DOI:10.1002/ptr.2103] [PMID]
15.Komosinska-Vassev K, Olczyk P, Kaźmierczak J, Mencner L, Olczyk K. Bee pollen: Chemical composition and therapeutic application. Evidence-Based Complementary and Alternative Medicine: eCAM. 2015; 2015:297425. [PMID]
16.Rzepecka-Stojko A, Pilawa B, Ramos P, Stojko J. Antioxidativeproperties of bee pollen extracts examined by EPR spectroscopy. Journal of Apicultural Science. 2012; 56(1):23-31. [DOI:10.2478/v10289-012-0003-0]
17.Tohamy AA, Abdella EM, Ahmed RR, Ahmed YK. Assessment of anti-mutagenic, anti-histopathologic and antioxidant capacities of Egyptian bee pollen and propolis extracts. Cytotechnology. 2014; 66(2):283-97. [DOI:10.1007/s10616-013-9568-0] [PMID] [PMCID]
18.Mohdaly AA, Mahmoud AA, Roby MH, Smetanska I, Ramadan MF. Phenolic extract from propolis and bee pollen: Composition, antioxidant and antibacterial activities. Journal of Food Biochemistry. 2015; 39(5):538-47. [DOI:10.1111/jfbc.12160]
19.Sarić A, Balog T, Sobocanec S, Kusić B, Sverko V, Rusak G, et al. Antioxidant effects of flavonoid from Croatian Cystus incanus L. rich bee pollen. Food and Chemical Toxicology. 2009; 47(3):547-54. [DOI:10.1016/j.fct.2008.12.007] [PMID]
20.Sistani Karampour N, Hemati AA, Malmir R. Effect of bee pollen hydro-alcoholic extract on nicotine induced anxiety in mice. National Journal of Physiology, Pharmacy and Pharmacology. 2016; 7(3):301-5. [DOI:10.5455/njppp.2017.7.0617914112016]
21.Hemati AA, Arzi A, Sistani Karampour N, Akbari B. Study of the effect of ocimum basilicum Hydro-Alcoholic extract on induced by nicotine in mice. Research Journal of Pharmaceutical, Biological and Chemical Sciences. 2015; 6(5):805-13. https://www.rjpbcs.com/pdf/2015_6(5)/[112].pdf
22.Sistani Karampour N, AA Hemmati, Ardeshir Malmir A. The anxiolytic effect of bee pollen hydroalcoholic extract in mice. National Journal of Physiology, Pharmacy and Pharmacology. 2017; 7(3):301-5. https://www.bibliomed.org/mnsfulltext/28/28-1467239128.pdf?1652613220
23.Yıldız O, Can Z, Saral O, Yuluğ E, Oztürk F, Aliyazıcıoğlu R, at al. Hepatoprotective potential of chestnut bee pollen on carbon tetrachloride-induced hepatic damages in rats. Evidence-Based Complementary and Alternative Medicine. 2013; 2013:461478. [DOI:10.1155/2013/461478] [PMID] [PMCID]
24.Ahangarpour A, Zeidooni L, Samimi A, Alboghobeish S, Khorsandi LS, Moradi M. Chronic exposure to arsenic and high fat diet additively induced cardiotoxicity in male mice. Research in Pharmaceutical Sciences. 2018; 13(1):47-56. [DOI:10.4103/1735-5362.220967] [PMID] [PMCID]
25.Sadegh C, Schreck RP. The spectroscopic determination of aqueous sulfite using Ellman’s reagent. MURJ. 2003; 8:39-43. https://www.researchgate.net/profile/Cameron-Sadegh/publication/267683433_The_Spectroscopic_Determination_of_Aqueous_Sulfite_Using_Ellman%27s_Reagent/links/548a1ad10cf214269f1ac253/The-Spectroscopic-Determination-of-Aqueous-Sulfite-Using-Ellmans-Reagent.pdf
26.Mirhoseini M, Talebpour Amiri F, Karimpour Malekshah AA, Rezanejad Gatabi Z, Ghaffari E. Protective effects of melatonin on testis histology following acute torsion-detorsion in rats. International Journal of Reproductive Biomedicine. 2017; 15(3):141-6. [DOI:10.29252/ijrm.15.3.141] [PMID] [PMCID]
27.Huang H, Shen Z, Geng Q, Wu Z, Shi P, Miao X. Protective effect of Schisandra chinensis bee pollen extract on liver and kidney injury induced by cisplatin in rats. Biomedicine & Pharmacotherapy. 2017; 95:1765-76. [DOI:10.1016/j.biopha.2017.09.083] [PMID]
28.Ramadhani MR, Bachri MS, Widyaningsih W. Effects of ethanolic extract of arrowroot tubers (Maranta arundinacea L.) on the level of MDA, SGPT and SGOT in ethanol induced rats. Jurnal Kedokteran dan Kesehatan Indonesia. 2017; 8(1):10-8. [DOI:10.20885/JKKI.Vol8.Iss1.art3]
29.Eraslan G, Kanbur M, Silici S, Cem Liman B, Altinordulu S, Soyer Sarica Z. Evaluation of protective effect of bee pollen against propoxur toxicity in rat. Ecotoxicology and Environmental Safety. 2009; 72(3):931-7. [DOI:10.1016/j.ecoenv.2008.06.008] [PMID]
30.Eraslan G, Kanbur M, Silici S. Effect of carbaryl on some biochemical changes in rats: The ameliorative effect of bee pollen. Food and Chemical Toxicology. 2009; 47(1):86-91. [DOI:10.1016/j.fct.2008.10.013] [PMID]
31.Leja M, Mareczek A, Wyżgolik G, Klepacz-Baniak J, Czekońska K. Antioxidative properties of bee pollen in selected plant species. Food chemistry. 2007; 100(1):237-40. [DOI:10.1016/j.foodchem.2005.09.047]
32.Arjariya S, Nema N, Tiwari S. Investigate the toxicological effect on aqueous extract of terminalia Catappa linn. in rat. International Journal of Research and Development in Pharmacy and Life Sciences. 2013; 2(5):596-601. https://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.392.2544&rep=rep1&type=pdf
33.Al-Daihan S, Bhat RS. Protective effect of bee pollen against sodium fluoride-induced hepatonephrotoxicity and serum electrolyte changes in rats. Fluoride. 2019 ; 52(1):9-17. https://www.fluorideresearch.org/521/files/FJ2019_v52_n1_p009-017_sfs.pdf


 ، محمدجواد باقری2
، محمدجواد باقری2 

 ، لعیا سادات خرسندی3
، لعیا سادات خرسندی3 

 ، زینب دهقان محمدی4
، زینب دهقان محمدی4 

 ، مریم سله چه*5
، مریم سله چه*5 

 ، هومن هنرمن6
، هومن هنرمن6 

