

Zareei A, Fallahi Khoshknab M, Vahedi M, Borzabadi Farahani Z, Rahgoi A. Investigating the Effect of Foot Reflexology Massage on Post-electroconvulsive Therapy Headache. cmja 2023; 12 (4) :33-39
URL:
http://cmja.arakmu.ac.ir/article-1-850-fa.html
زارعی عطیه، فلاحی خشکناب مسعود، واحدی محسن، برزآبادی فراهانی زهرا، ره گوی ابوالفضل. بررسی تأثیر ماساژ بازتابی پا بر میزان سردرد بیماران، پس از الکتروشوک درمانی. فصلنامه طب مکمل. 1401; 12 (4) :33-39
URL: http://cmja.arakmu.ac.ir/article-1-850-fa.html
1- گروه پرستاری، دانشگاه علوم توانبخشی و سلامت اجتماعی، تهران، ایران
2- گروه آمار زیستی و اپیدمیولوژی، مرکز تحقیقات سوء مصرف و وابستگی به مواد، دانشگاه علوم توانبخشی و سلامت اجتماعی، تهران، ایران
3- دانشکده پرستاری، دانشگاه علوم پزشکی اراک، اراک، ایران
4- گروه پرستاری، دانشگاه علوم توانبخشی و سلامت اجتماعی، تهران، ایران ، rahgouin@yahoo.com
متن کامل [PDF 629 kb]
(373 دریافت)
|
چکیده (HTML) (758 مشاهده)
متن کامل: (123 مشاهده)
مقدمه
ورزش تناوبی پرشدت نقش قابل قبولی در فرایند سازگاریهای میتوکندریایی (1) از جمله افزایش ظرفیت هوازی و محتوای میتوکندریایی (2) در عضله اسکلتی دارد که این سازگاریها نتیجه اثرات تجمعی پاسخهای رونویسی میباشد (3). در این بین گیرنده فعالکننده تکثیرپروکسیزوم گاما هم فعالساز آلفا ((PGC-1α مهمترین تنظیم کننده محتوای میتوکندریایی در شروع این پاسخهای مولکولی سازگارانه تأثیر دارد (1) که به واسطه اثر تعاملی و برهمکنش PGC-1α با دیگر فاکتورهای رونویسی هستهای از جمله فاکتور تنفس هستهای 1 و 2(NRF1,2) به وقوع میپیوندد (4). این کواکتیویتور (هم فعال ساز) رونویسی با تأثیر بر فعالیت رونویسی NRF1,2، تنظیم کننده بیان ژنهای هستهای، سبب بیان فاکتور رونویسی A میتوکندریایی (TFAM) و فعالسازی آن میشود (5)؛ از طرفی TFAM برای شروع نسخهبرداری میتوکندریایی ضروری است (6) و رونویسی و همانند سازی DNA میتوکندریایی (mtDNA) را تنظیم میکند (4) که با میزان ژنهای میتوکندریایی و همینطور با فعالیت تنفس میتوکندریایی همبستگی دارد (7). به نظر میرسد PGC-1α و TFAM در هماهنگ کردن ژنهای هستهای و میتوکندریایی مورد نیاز در افزایش محتوای میتوکندریایی نقش دارند (8). در مطالعات مختلف اثر تمرین تناوبی پرشدت بر بیان فاکتورهای رونویسی و تنظیم بیوژنز میتوکندریایی مورد بررسی قرار گرفته و نشان داده شده تمرین تناوبی پرشدت همانند ورزش استقامتی سطح مشابهی از سازگاریهای فیزیولوژیکی را موجب میشود (9). گزارش شده است که دو هفته تمرین تناوبی پرشدت با حجم تمرینی پایین سبب افزایش ظرفیت میتوکندریایی عضله، فعالیت و محتوای آنزیمهای میتوکندریایی و همین طور افزایش PGC-1α و TFAM هستهای در عضله اسکلتی انسان شده است (8). همین طور اثر 3 هفته تمرین تناوبی پرشدت بر روی تردمیل در افزایش سطح سرمی و نیز عضلانی ژنهای میتوکندریایی PGC-1α و TFAM در رت ها معنادار بوده است (10). اما بررسی تأثیرات مولکولی تمرینات تناوبی پرشدت در عضله اسکلتی نشان داده همچنان که شدت تمرین افزایش مییابد، سطح لاکتات خون و عضله (11) و مصرف اکسیژن به طور چشمگیری افزایش مییابد (12). با تجمع لاکتات و مصرف اکسیژن، تولید گونههای اکسیژن فعال شده (ROS)، یکی از مهمترین مداخلهگرها در سازگاریهای ورزشی افزایش مییابد (13). با این حال افزایش ROS و رادیکالهای اکسیژن سبب آسیب اکسیداتیو به mtDNA و کاهش پروتئینهای میتوکندریایی میشود (14). از طرفی تولید اسیدلاکتیک با تجمع یون هیدروژن (H+) و لاکتات، درون عضلات فعال و خون همراه است (15) که تجمع H+، فسفریلاسیون اکسیداتیو، فعالیت آنزیمی و تنظیم یون را حین ورزش تحت تأثیر قرار میدهد (16). کاهش سطح PH پیامد تجمع لاکتات و H+ میباشد (15) که بعضی از آنزیمهای گلیکولیتیکی را کاهش داده و رهایی Ca+2 از رتیکولوم سارکوپلاسمایی (17) و نیز سنتز پروتئین عضله (18) را مهار میکند. همچنین میزان اسیدوز حین ورزش، بیان پروتئینهای سیگنالینگ مولکولی از جمله فسفریلاسیون پروتئین کیناز B و نیز بیان ژنهای تنظیم کننده بیوژنز میتوکندریایی مثل AMPK را تحت تأثیر قرار میدهد و باعث کاهش بیش تنظیمی PGC-1α القا شده توسط ورزش میشود (18). مکملهای آلکالیزه کنندهی بی کربنات سدیم و سیترات سدیم (19) به عنوان متداولترین گزینههای بهبود ظرفیت بافری خون شناخته شدهاند (15) و بنا بر نتایج مطالعات، مصرف مکملهای بی کربنات سدیم و سیترات سدیم پیش از فعالیت ورزشی شدید سبب کاهش تجمع H+ در عضله اسکلتی، خون و آب میان بافتی شده (20)، تجمع بیکربنات (HCO3-) و تولید ATP گلیکولیتیکی را افزایش میدهد؛ همچنین باعث تأخیر در افت PH درونسلولی گردیده و ظرفیت بافرینگ (19) و عملکرد ورزشی را بهبود میبخشد (20). با این حال مصرف بیکربنات سدیم باعث مشکلات گوارشی میشود (21) و اغلب ورزشکاران ترجیح میدهند از این مکمل استفاده نکنند. در مقابل سیترات سدیم اختلالات گوارشی کمتری از خود نشان داده است (15) و میتواند مزیتهای بیکربنات سدیم را بدون اثرات منفی و سوء داشته باشد (17)؛ بنابراین میتواند یک جایگزین مناسب برای جلوگیری از اسیدوز عضلات بدون مشکلات گوارشی شود.
اگرچه برخی مطالعات به بررسی تأثیر تمرینات تناوبی پرشدت بر فاکتورهای رونویسی PGC-1α و TFAM پرداختهاند اما تاکنون مطالعهای تأثیر تمرین تناوبی پرشدت به همراه مکمل دهی سیترات سدیم را بر PGC-1α و TFAM بررسی نکرده است بنابراین هدف از پژوهش حاضر بررسی تأثیر هشت هفته فعالیت ورزشی تناوبی شدید همراه با مکملدهی سیترات سدیم بر بیان پروتئینهای PGC-1α و TFAM میباشد.
روش کار
در این تحقیق تجربی تعداد بیست و چهار سر رت از نژاد ویستار انتخاب شدند و به صورت دستههای هشت تایی در سه گروه کنترل، تمرین و تمرین همراه با مکمل سترات سدیم قرار گرفتند. رت ها در آزمایشگاه حیوانهای آزمایشگاهی با میانگین دمای 21-23 درجه سانتی گراد و رطوبت 45 تا 55 درصد، چرخه روشنایی-تاریکی (4 بعدازظهر تا 4 صبح با 12 ساعت روشنایی و 12 ساعت تاریکی)، با دسترسی آزاد به آب و غذا نگه داری شدند.
دو هفته پیش از اجرای پروتکل تمرینی، رتها جهت آشنایی و خوگیری با تردمیل تحت آموزش قرار گرفتند. شیب تردمیل در اولین جلسه خوگیری صفر درجه و سرعت آن 15 متر/دقیقه بود. در جلسات بعدی آشناسازی، شیب تردمیل هر دو روز یک بار به اندازه 5 درجه افزایش یافت. همین طور هر روز سرعت به میزان 2 متر/دقیقه و مدت تمرین به اندازه 2 دقیقه افزایش داده شد (22). یک هفته بعد از جلسات آشنایی و خوگیری با تردمیل میزان سرعت دویدن بیشینه در رت ها اندازه گیری شد. رت های گروه تمرین به مدت 8 هفته و 5 روز در هفته تمرینات تناوبی را به ترتیب با دامنه شدت 50 و 90 درصد حداکثر ضربان قلب بیشینه به مدت 3 دقیقه و در 6 دور اجرا کردند. رتهای گروه تمرین همراه با مکمل نیز همان پروتکل تمرینی مشابه را انجام دادند با این تفاوت که این گروه در هر جلسه، سه ساعت پیش از تمرین، مقدار 15 میلیمول/ لیتر از مکمل سیترات سدیم را به شکل محلول در آب دریافت کردند.
آماده سازی و نمونه برداری
نمونه برداری از بافت عضله نعلی انجام گرفت. استخراج پروتئین عضله نعلی با استفاده از تست (RIPA) radio immunoprecipitation assay با غلظت 05/0 میلی مولار بافر تریس (PH=8)، 150 میلی مولار کلرید سدیم، 01/0 درصد EG-TA، 1 درصد SDS به علاوه 1/0 درصد آنتی پروتئاز کوکتیل (ROCHE) انجام شد. بدین منظور 100 میلی گرم از بافت در 500 میکرولیتر محلول بافر آنتی پروتئاز با هموژنایزر دستی هموژن شد و به مدت 30 دقیقه در 4 درجه سانتی گراد قرار داده شد. سپس در سانتریفیوژ یخچال دار (bo, sw14rfroil) با 12000 دور/دقیقه به مدت 10 دقیقه در دمای 4 درجه سانتی گراد سانتریفیوژ شد. مایع رویی جمع آوری شده و غلظت پروتئین آن توسط کیت سانتا کروز ساخت کشور آمریکا و دستگاه میکروپلیت (Bio-Rad با طول موج 595) تعیین گردید. در انتها در دمای 20 درجه سانتی گراد زیر صفر نگه داری شد. هموژن به دست آمده با نسبت 1:1 با نمونه بافر لودینگ (50 میلی مولار تریس کلرید هیدروژن، 2 درصد سدیم دودسیل سولفات، 005/0 درصد بروموفنل آبی، 1 درصد گلیسرول، 5 درصد مرکاپتواتانول بتا) مخلوط گردید. در ادامه نمونهها به مدت 5 دقیقه جوشانده شدند تا پروتئین کاملاً دناتوره شود. پروتئینها با استفاده از الکتروفورز ژل SDSpolyacrylamide جدا شده و به غشای نیترو سلولزی انتقال داده شدند. غشا به مدت یک ساعت در 1/0 درصد (Tween 2 TBST) و 5 درصد BSA در Tris-Buffered Saline مسدود شد؛ سپس در درون آنتی بادی اولیه با نسبت 1:500 انکوبه شد. انکوباسیون آنتی بادی ثانویه روز بعد به مدت یک ساعت در دمای محیط با نسبت 1:200 در 4 درصد TBST انجام شد. پروتئین با یک واکنش شیمیایی لومینسانس (ECL) و با آنالیز دنسیتومتری نرم افزار Image J اندازه گیری شد. آنتی بادیهای اولیه و ثانویه PGC-1α (SANTA CRUZ sc-47778)، TFAM (SANTA CRUZ sc-166965) و beta actin (SANTA CRUZ ab-54481) به کار گرفته شدند.
روش تجزیه وتحلیل آماری
برای اطمینان از طبیعی بودن توزیع دادهها، آزمون شاپیروویلک مورد استفاده قرار گرفت. نتایج حاصل از پژوهش به صورت میانگین ± انحراف استاندارد بیان شد. برای بررسی اختلاف معناداری در 3 گروه از آزمون آماری پارامتریک آنوا در سطح P<0.05 و آزمون تعقیبی توکی استفاده شد. تجزیه تحلیل دادهها به کمک نرمافزار SPSS نسخه 27 صورت گرفت. همچنین از نرمافزار گراف پد پریزم 9 برای ترسیم نمودارها استفاده شد.
یافتهها
نتایج مربوط به آزمون آنالیز واریانس یک طرفه برای PGC-1α و TFAM نشان داد بین سه گروه کنترل، تمرین و گروه تمرین+مکمل در بیان PGC-1α و TFAM اختلاف معناداری وجود دارد (001/0 P=؛ جدول 1). همین طور نتایج آزمون تعقیبی توکی نشان داد که اختلاف میانگین PGC-1α در دو گروه تمرین و تمرین+مکمل نسبت به گروه کنترل معنادار بوده است (001/0P=؛ جدول 2). مقایسه نتایج آزمون تعقیبی توکی برای TFAM در بین سه گروه نشان داد در مقایسه با گروه کنترل هر دو گروه تمرین و تمرین+مکمل دارای اختلاف معناداری بودند (001/0P=) اما اختلاف میانگین بین دو گروه تمرین و تمرین+مکمل معنادار نبود (134/0P=؛ جدول 2).
جدول 1. نتایج آنوا برای PGC-1α و TFAM در رت های مورد بررسی
| شاخص / گروه |
میانگین±انحراف استاندارد |
CI 95% |
F |
Sig |
| PGC-1α |
|
|
08/65 |
001/0 |
| کنترل |
00/0±00/1 |
00/1 تا 00/1 |
|
|
| تمرین |
80/0±13/1 |
06/1 تا 21/1 |
|
|
| تمرین+مکمل |
22/0±58/1 |
56/1 تا 60/1 |
|
|
| TFAM |
|
|
07/14 |
001/0 |
| کنترل |
00/0±00/1 |
00/1 تا 00/1 |
|
|
| تمرین |
06/0±70/1 |
64/1 تا 75/1 |
|
|
| تمرین+مکمل |
43/0±97/1 |
57/1 تا 38/2 |
|
|
جدول 2. نتایج آزمون تعقیبی توکی برای PGC-1α و TFAM
| گروه / مقایسهها |
اندازه اثر (CI 95%) |
sig |
| PGC-1α |
|
|
| کنترل |
|
|
| تمرین |
09/0(20/0- تا 07/0-) |
001/0 |
| تمرین + مکمل |
40/0(65/0- تا 51/0-) |
001/0 |
| تمرین + مکمل |
|
|
| تمرین |
31/0(38/0 تا 51/0) |
001/0 |
| TFAM |
|
|
| کنترل |
|
|
| تمرین |
70/0(04/1- تا 35/0-) |
001/0 |
| تمرین + مکمل |
97/0(32/1- تا 62/0-) |
001/0 |
| تمرین + مکمل |
|
|
| تمرین |
27/0(07/0- تا 62/0) |
134/0 |
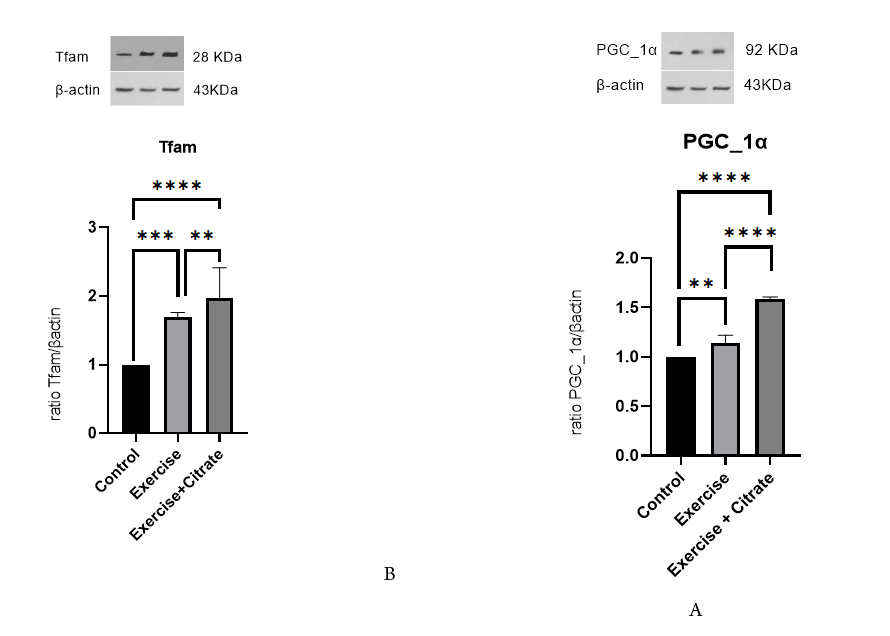 شکل 1. A) نسبت تغییرات بیان PGC-1α در سه گروه. B) نسبت تغییرات بیان TFAM در سه گروه
شکل 1. A) نسبت تغییرات بیان PGC-1α در سه گروه. B) نسبت تغییرات بیان TFAM در سه گروه
بحث
هدف از پژوهش حاضر بررسی تأثیر هشت هفته تمرین تناوبی پرشدت همراه با مکمل دهی سیترات سدیم بر بیان PGC-1α و TFAM بود. نتایج نشان داد هشت هفته تمرین تناوبی پرشدت بر افزایش بیان هر دو پروتئین PGC-1α و TFAM در عضله نعلی رت های ویستار اثر معناداری دارد. در این رابطه شرفی دهرحم و همکاران نشان دادند 3 هفته تمرین تناوبی پرشدت بر روی تردمیل بر افزایش سطح سرمی و نیز عضلانی ژنهای میتوکندریایی PGC-1α و TFAM در رتها تأثیر معناداری داشته است. در پژوهش آنها، بیان هر دو پروتئین، در عضله تند انقباض (عضله بازکننده بلند انگشتان) در مقایسه با عضله کند انقباض (عضله نعلی) افزایش بیشتری داشته که علت آن ماهیت تمرین تناوبی پرشدت گزارش شده است (10). هم چنین بختیاری و همکاران به مدت 12 هفته به بررسی اثر دو نوع فعالیت ورزشی بر بیان پروتئینهای میتوکندریایی در عضله دوقلوی رت های سالمند پرداختند و نشان دادند هر دو نوع تمرین بر بیان TFAM اثر داشته و آنرا افزایش میدهد درحالیکه تمرین تناوبی پرشدت در مقایسه با تمرین تداومی با شدت متوسط بر بیان PGC-1α تأثیر بیشتری داشته است (23).
تمرینات تناوبی پرشدت در سطح مولکولی سبب تحریک مسیرهای سیگنالینگ در عضله اسکلتی و فعال سازی PGC-1α میشود. انجام تمرینات با شدت بالا سبب افزایش رهایی Ca+2 میگردد (2). Ca+2 از طریق مکانیزم های مختلفی مثل افزایش مصرف اکسیژن و یا تولید نیتریک اکساید سبب تولید ROS میگردد که همراه با افزایش Ca+2 سطح ROS نیز افزایش مییابد. هم چنین افزایش سطح Ca+2 سبب افزایش سنتز ATP میشود (24). از آنجا که فعالیت ورزشی با افزایش تقاضای انرژی همراه است با شدت یافتن ورزش و افزایش تقاضا، نسبت AMP و ADP به ATP افزایش مییابد (11). افزایش Ca+2، ROS و AMP باعث میشود تا پروتئینهای سیگنالینگ درونسلولی حساس به این مولکولها از جمله کلسیم کالمودولین وابسته به کیناز (CaMK)، آدنوزین مونوفسفات کیناز (AMPK) و پروتئین کیناز فعال شده توسط میتوژن P38 (P38 MAPK) فعال سازی شوند (25). این کینازها منجر به تحریک بیان و تنظیم فاکتور رونویسی کلیدی اثرگذار در متابولیسم انرژی و بیوژنز میتوکندریایی PGC-1α میگردند (26). بدین ترتیب، PGC-1α فعال شده توسط تمرین تناوبی شدید با اتصال به فاکتورهای رونویسی، باعث فعال سازی و بیان ژنهای میتوکندریایی هستهای NRF1,2 و TFAM میگردد (27).
یافتههای پژوهش حاضر همچنین نشان داد تمرین تناوبی شدید همراه با مکمل دهی سیترات سدیم بر بیان PGC-1α و TFAM تأثیر دارد. شواهد نشان میدهد مکمل دهی بی کربنات سدیم و سیترات سدیم پاسخهای متابولیکی به ورزش را تغییر داده و سازگاریها را افزایش میدهد. نتایج مطالعات إج و همکاران نشان میدهد مصرف بی کربنات سدیم پیش از ورزش سبب بهبود سازگاری میتوکندریایی میشود. در این پژوهش که به مدت 8 هفته (3 روز در هفته) تمرین رکاب زنی ارگومتر (6-12 دور به مدت 2 دقیقه) با 170-140 درصد آستانه لاکتات انجام گرفت، کاهش اسیدوز متابولیک و بهبود حجم و تنفس میتوکندریایی عضلانی با مصرف بی کربنات سدیم گزارش شده است (16). لینوسییر و همکاران اثر مکمل سیترات سدیم به عنوان عامل آلکالیزه کننده برون سلولی را در فعالیت فرابیشینه که با 120 درصد حداکثر اکسیژن مصرفی و تا زمان بروز خستگی ادامه داشت بر عملکرد و متابولیسم عضله اسکلتی ارزیابی کردند. نتایج حاصل نشان داد مصرف مکمل سیترات سدیم سبب تأخیر در زمان بروز خستگی و بهبود عملکرد شده است. مصرف سیترات سدیم با تأثیر بر آلکالیزه شدن پلاسما بر عملکرد و متابولیسم عضله اثر کرده است (21). همچنین مطالعات اوپیک و همکاران در بررسی اثر مصرف مکمل سیترات سدیم پیش از ورزش بر متابولیسم و ظرفیت عملکرد نشان دادند مصرف این مکمل، احتباس آب، حجم پلاسما و PH خون را افزایش داده و افزایش تجمع گلوکز خون را مهار کرده اگرچه در بهبود عملکرد ورزشکاران تأثیری نداشته است (28). در راستای تحقیق حاضر تنها مطالعه موجود که تأثیر مکمل بافر کننده را بر آبشارهای سیگنالینگ و بیان ژن مرتبط با بیوژنز میتوکندریایی بررسی کرده مطالعه پرسیوال و همکاران بود که نشان داد مصرف مکمل بی کربنات سدیم، بیان PGC-1α mRNA را بعد از تمرین و در زمان ریکاوری در عضله اسکلتی افزایش داده است. در این پژوهش آزمودنیها پیش از اجرای پروتکل تمرینی مقدار 2/0 گرم مکمل بی کربنات سدیم را به ازای هر کیلوگرم از وزن بدن مصرف کردند، سپس یک پروتکل تمرینی را در دو موقعیت با فاصله یک هفته از هم اجرا کردند. تمرین آنها شامل اجرای 10×60 ثانیه رکاب زنی با 90 درصد حداکثر ضربان قلب بیشینه به همراه 60 ثانیه ریکاوری بود. نتایج حاصل از بیوپسی عضله و نمونه خون نشان داد در گروه مکمل، PH و بی کربنات خون بعد از مصرف بی کربنات سدیم افزایش یافته است؛ همین طور مصرف گلیکوژن عضلانی و تجمع لاکتات خون در طول تمرین افزایش یافته است. افزایش فسفریلاسیون استیل کوآ کربوکسیلاز، مارکر پایین دستی MAPK و P38AMPK در هر دو گروه کنترل (تمرین همراه با مکمل کلراید سدیم) و مکمل (تمرین همراه با بی کربنات سدیم) یکسان گزارش شده است اما در مقادیر MAPK و P38AMPK افزایشی مشاهده نشده است. با اینحال بیان,PGC-1α mRNA 3 ساعت بعد از ریکاوری در گروه مکمل بالا بوده است (29). از آنجا که گلیکولیز بی هوازی با تولید اسید لاکتیک همراه است، این امر منجر به کاهش PH و برهم خوردن تعادل اسیدی خون میشود (30) که بر عملکرد عضلانی تأثیر میگذارد. به عبارتی تغییرات PH ضمن تغییر خواص کانالهای پروتئینی سبب کاهش فعالیت آنزیمهای کلیدی در گلیکولیز و کاهش میزان تولید ATP میشود (31). علاوه بر این عملکرد میتوکندریایی تحت تأثیر تغییرات PH تغییر میکند. کاهش PH میتواند بیان ژنهای دخیل در بیوژنز میتوکندریایی از جمله PGC-1α را کاهش دهد (32).
در مطالعه حاضر، مسیرهای سیگنالینگ PGC-1α و TFAM و همین طور تغییرات لاکتات، H+ و PH اندازه گیری نشده است اما با توجه به نتایج به دست آمده از مطالعات گذشته میتوان چنین استنباط کرد افزایش بیان PGC-1α میتواند متأثر از اختلالات متابولیکی حاصل از تمرین تناوبی پرشدت باشد که بر مسیرهای سیگنالینگ اثر کرده و احتمالاً افزایش بیان و فعال سازی پروتئینهای بالادستی تنظیم کننده PGC-1α و متعاقباً تحریک بیان PGC-1α را درپی داشته باشد. از طرفی مکمل یاری سیترات سدیم همراه با تمرینات تناوبی پرشدت در افزایش بیان PGC-1α اثر داشته است که شاید بتوان مکانیزم اثر سیترات سدیم در افزایش بیان PGC-1α را با مکانیزم اثر مکمل بیکربنات سدیم یکسان مفروض دانست که با تأثیر بر سطح PH و بی کربنات خون سبب افزایش بیان PGC-1α mRNA گردیده است (29). همین طور PGC-1α از طریق هم فعال سازی و تعامل با فاکتورهای رونویسی NRF1,2 واقع بر روی پروموتر TFAM سبب فعال سازی و بیان این فاکتور رونویسی میشود (33)؛ بنابراین ممکن است افزایش بیان TFAM به دنبال تمرین تناوبی پرشدت، متأثر از افزایش بیان PGC-1α باشد.
نتیجه گیری
از آنجا که تمرین تناوبی پرشدت به عنوان یکی از روشهای تمرینی محرک سازگاریهای فیزیولوژیکی، در بیان فاکتورهای رونویسی PGC-1α و TFAM تأثیردارد؛ همچنین با توجه به تأثیرات مکمل سیترات سدیم در افزایش بیان این فاکتورهای رونویسی، به نظر میرسد بتوان با بهره گیری از اثرات هم افزایی مکمل یاری سیترات سدیم در کنار تمرینات تناوبی پرشدت با افزایش القاء بیان پروتئینهای PGC-1α و TFAM از اثرات فیزیولوژیکی آنها در بهبود ظرفیت ورزشی و اجرا و عملکرد ورزشکاران بهره برد.
ملاحظات اخلاقی
تمامی اصول اخلاقی پژوهش در این مقاله رعایت شده است و با کد IR.UMA.REC. 1400.074 به تصویب دانشگاه محقق اردبیلی است.
حامی مالی
این مقاله برگرفته از طرح پایان نامه کارشناسی ارشد مصوب معاونت پژوهشی دانشگاه محقق اردبیلی است.
مشارکت نویسندگان
تمامی نویسندگان در طراحی، اجرا و نگارش همه بخشهای پژوهش مشارکت داشتهاند. نویسندگان تصریح میکنند که هیچگونه تعارض منافع وجود ندارد.
تشکر و قدرانی
محققین بر خود لازم میدانند از زحمات آزمایشگاه سارای که با دقت بالا آزمایشات بخش بلاتینگ را انجام دادند تشکر و قدردانی نمایند.
References
1. Fiorenza M, Gunnarsson TP, Hostrup M, Iaia FM, Schena F, Pilegaard H, et al. Metabolic stress-dependent regulation of the mitochondrial biogenic molecular response to high-intensity exercise in human skeletal muscle. J Physiol. 2018;596(14):2823-2840. doi: 10.1113/JP275972 pmid: 29727016
2. MacInnis MJ, Gibala MJ. Physiological adaptations to interval training and the role of exercise intensity. J Physiol. 2017;595(9):2915-2930. doi: 10.1113/JP273196 pmid: 27748956
3. Brandt N, Dethlefsen MM, Bangsbo J, Pilegaard H. PGC-1alpha and exercise intensity dependent adaptations in mouse skeletal muscle. PLoS One. 2017;12(10):e0185993. doi: 10.1371/journal.pone.0185993 pmid: 29049322
4. Perry CG, Lally J, Holloway GP, Heigenhauser GJ, Bonen A, Spriet LL. Repeated transient mRNA bursts precede increases in transcriptional and mitochondrial proteins during training in human skeletal muscle. J Physiol. 2010;588(Pt 23):4795-4810. doi: 10.1113/jphysiol.2010.199448 pmid: 20921196
5. Gureev AP, Shaforostova EA, Popov VN. Regulation of Mitochondrial Biogenesis as a Way for Active Longevity: Interaction Between the Nrf2 and PGC-1alpha Signaling Pathways. Front Genet. 2019;10:435. doi: 10.3389/fgene.2019.00435 pmid: 31139208
6. Gordon JW, Rungi AA, Inagaki H, Hood DA. Effects of contractile activity on mitochondrial transcription factor A expression in skeletal muscle. J Appl Physiol (1985). 2001;90(1):389-396. doi: 10.1152/jappl.2001.90.1.389 pmid: 11133932
7. Chandrasekaran K, Anjaneyulu M, Choi J, Kumar P, Salimian M, Ho CY, et al. Role of mitochondria in diabetic peripheral neuropathy: Influencing the NAD(+)-dependent SIRT1-PGC-1alpha-TFAM pathway. Int Rev Neurobiol. 2019;145:177-209. doi: 10.1016/bs.irn.2019.04.002 pmid: 31208524
8. Little JP, Safdar A, Wilkin GP, Tarnopolsky MA, Gibala MJ. A practical model of low-volume high-intensity interval training induces mitochondrial biogenesis in human skeletal muscle: potential mechanisms. J Physiol. 2010;588(Pt 6):1011-1022. doi: 10.1113/jphysiol.2009.181743 pmid: 20100740
9. Memme JM, Erlich AT, Phukan G, Hood DA. Exercise and mitochondrial health. J Physiol. 2021;599(3):803-817. doi: 10.1113/JP278853 pmid: 31674658
10. Sharafi Dehrhm FSR, Rastegar Mogaddam Mansouri M, Abbasian S. The effect of high intensity interval training on muscular biomarkers of mitochondrial biogenesis in male rats. [persian]. J Babol Univ Med. 2017;19(6):57 -63.
11. Torma F, Gombos Z, Jokai M, Takeda M, Mimura T, Radak Z. High intensity interval training and molecular adaptive response of skeletal muscle. Sports Med Health Sci. 2019;1(1):24-32. doi: 10.1016/j.smhs.2019.08.003 pmid: 35782463
12. Scribbans TD, Vecsey S, Hankinson PB, Foster WS, Gurd BJ. The effect of training intensity on VO2max in young healthy adults: a meta-regression and meta-analysis. Int J Exercise Sci. 2016;9(2):230.
13. Nikooie R, Moflehi D, Zand S. Lactate regulates autophagy through ROS-mediated activation of ERK1/2/m-TOR/p-70S6K pathway in skeletal muscle. J Cell Commun Signal. 2021;15(1):107-123. doi: 10.1007/s12079-020-00599-8 pmid: 33398722
14. Guo C, Sun L, Chen X, Zhang DJNrr. Oxidative stress, mitochondrial damage and neurodegenerative diseases. 2013;8(21):2003.
15. Cerullo G, Parimbelli M, Perna S, Pecoraro M, Liguori G, Negro M. Sodium citrate supplementation: An updated revision and practical recommendations on exercise performance, hydration status, and potential risks. 2020;3(6):518-525. doi: 10.1002/tsm2.174
16. Edge J, Bishop D, Goodman C. Effects of chronic NaHCO3 ingestion during interval training on changes to muscle buffer capacity, metabolism, and short-term endurance performance. J Appl Physiol (1985). 2006;101(3):918-925. doi: 10.1152/japplphysiol.01534.2005 pmid: 16627675
17. Oopik V, Saaremets I, Medijainen L, Karelson K, Janson T, Timpmann S. Effects of sodium citrate ingestion before exercise on endurance performance in well trained college runners. Br J Sports Med. 2003;37(6):485-489. doi: 10.1136/bjsm.37.6.485 pmid: 14665584
18. Bishop DJ, Thomas C, Moore-Morris T, Tonkonogi M, Sahlin K, Mercier J. Sodium bicarbonate ingestion prior to training improves mitochondrial adaptations in rats. Am J Physiol Endocrinol Metab. 2010;299(2):E225-233. doi: 10.1152/ajpendo.00738.2009 pmid: 20484007
19. Suvi S, Mooses M, Timpmann S, Medijainen L, Unt E, Oopik V. Influence of Sodium Citrate Supplementation after Dehydrating Exercise on Responses of Stress Hormones to Subsequent Endurance Cycling Time-Trial in the Heat. Medicina (Kaunas). 2019;55(4). doi: 10.3390/medicina55040103 pmid: 31013820
20. Mohammadpour HPJ, Azai K, Poozesh R. The effect of sodium bicarbonate supplementation on lactic acid, ammonia and exercise performance in 400 meter male runners. [persian]. J Sport Bioscie. 2010;2(4):79-92.
21. Linossier MT, Dormois D, Bregere P, Geyssant A, Denis C. Effect of sodium citrate on performance and metabolism of human skeletal muscle during supramaximal cycling exercise. Eur J Appl Physiol Occup Physiol. 1997;76(1):48-54. doi: 10.1007/s004210050211 pmid: 9243169
22. DiCarlo SE, Collins HL, Rodenbaugh DW, Smitha MR, Berger RD, Yeragani VK. Daily exercise reduces measures of heart rate and blood pressure variability in hypertensive rats. Clin Exp Hypertens. 2002;24(3):221-234. doi: 10.1081/ceh-120003202 pmid: 11883793
23. Bakhtiyari AGA, Choobineh S, Kordi MR, Hedayati M. The comparison of the influence of 12-week high- intensity interval training and continuous moderate intensity training on PGC-1α and Tfam mitochondrial proteins expressions in gastrocnemius muscle of elderly rats. [persian]. J Animal Biol. 2019;11(4):11-20.
24. Brookes PS, Yoon Y, Robotham JL, Anders MW, Sheu SS. Calcium, ATP, and ROS: a mitochondrial love-hate triangle. Am J Physiol Cell Physiol. 2004;287(4):C817-833. doi: 10.1152/ajpcell.00139.2004 pmid: 15355853
25. Kang C, Li Ji L. Role of PGC-1alpha signaling in skeletal muscle health and disease. Ann N Y Acad Sci. 2012;1271(1):110-117. doi: 10.1111/j.1749-6632.2012.06738.x pmid: 23050972
26. Sabaratnam R, Pedersen AJ, Eskildsen TV, Kristensen JM, Wojtaszewski JFP, Hojlund K. Exercise Induction of Key Transcriptional Regulators of Metabolic Adaptation in Muscle Is Preserved in Type 2 Diabetes. J Clin Endocrinol Metab. 2019;104(10):4909-4920. doi: 10.1210/jc.2018-02679 pmid: 31135885
27. Gahramani MKS. Effect of eight weeks high intensity interval training on NRF-1,2 and Tfam gene expressione levels in ST muscles in rats with myocardial infarction. [Persian]. Med J Tabriz Uni Med Sci Health Service. 2020;41(6):75-82. doi: 10.34172/mj.2020.009
28. Oopik V, Saaremets I, Timpmann S, Medijainen L, Karelson K. Effects of acute ingestion of sodium citrate on metabolism and 5-km running performance: a field study. Can J Appl Physiol. 2004;29(6):691-703. doi: 10.1139/h04-044 pmid: 15630143
29. Percival ME, Martin BJ, Gillen JB, Skelly LE, MacInnis MJ, Green AE, et al. Sodium bicarbonate ingestion augments the increase in PGC-1alpha mRNA expression during recovery from intense interval exercise in human skeletal muscle. J Appl Physiol (1985). 2015;119(11):1303-1312. doi: 10.1152/japplphysiol.00048.2015 pmid: 26384407
30. Chycki J, Kurylas A, Maszczyk A, Golas A, Zajac A. Alkaline water improves exercise-induced metabolic acidosis and enhances anaerobic exercise performance in combat sport athletes. PLoS One. 2018;13(11):e0205708. doi: 10.1371/journal.pone.0205708 pmid: 30452459
31. Gharahdaghi NKM, Gaein A. Fatigue specific functional and metabolic factors changes in response to a period of high intensity aerobic training in soccer players. [Persian]. J Sport Physiol. 2014;5(20):81-96.
32. Genders AJ, Martin SD, McGee SL, Bishop DJ. A physiological drop in pH decreases mitochondrial respiration, and HDAC and Akt signaling, in L6 myocytes. Am J Physiol Cell Physiol. 2019;316(3):C404-C414. doi: 10.1152/ajpcell.00214.2018 pmid: 30649921
33. Ventura-Clapier R, Garnier A, Veksler V. Transcriptional control of mitochondrial biogenesis: the central role of PGC-1alpha. Cardiovasc Res. 2008;79(2):208-217. doi: 10.1093/cvr/cvn098 pmid: 18430751
نوع مطالعه:
كاربردي |
موضوع مقاله:
پرستاری و مامایی

