مقدمه
دیابت یکی از شایعترین اختلالات غدد درونریز است [
1]. تغییر شیوه زندگی و رژیمهای غذایی باعث شیوع دیابت در سراسر جهان شد. دیابت یک بیماری بومی جهانی است. در سال 2019، 463 میلیون بزرگسال (20 تا 79 ساله) با دیابت زندگی میکردند و در همان سال فقط بعد از چند ماه گزارش شد که دیابت باعث مرگ 4/2 میلیون نفر شد. تعداد بیماران مبتلا به دیابت با سرعت بسیار بالایی در حال افزایش است و تخمین زده میشود تا سال 2045 به 700 میلیون نفر برسد [
2]. شرایط قند خون بالا باعث افزایش استرس اکسیداتیو میشود که با ریسک بالای عوارض دیابتی در انواع مختلف بافت همراه است. پوکی استخوان مرتبط با دیابت کاهش کیفیت عضله و بیماریهای قلبیعروقی از عوارض ناشی از دیابت است که ناشی از تداخل در فعالیت آنزیمهای آرژیناز است [
3].
آرژیناز یک آنزیم مهم در چرخه اوره برای تبدیل ال ارژینین به اوریتین و اوره است که در دو ایزوفرم مجزا (آرژیناز I و II) وجود دارد [
4]. افزایش بیان آنزیم آرژیناز ممکن است به کاهش سطح ال آرژنین سلولی و بافت منجر شود [
5]. این کاهش سطح ال آرژنیننیتریک اکساید سنتاز اندوتلیالی (سوبسترای آنزیم) نقش مهمی در مختل شدن نیتریکاکساید قابلدسترس و ایجاد اختلال عملکرد اندوتلیال در هایپرگلیسمی بازی میکند. مسیرهای سیگنالدهی داخلسلولی در تقویت بیان یا فعالیت آرژیناز، کمتر درک شدهاند. یکی از زیرمجموعههای پروتئین کیناز فعال شده به وسیله میتوژن یعنی P38 به نظر میرسد در پاسخ به هایپرگلیسمی و استرس اکسیداتیو بهطور بالقوه فعال میشوند [
6]. اخیراً گزارش شده است که P38 فعالشده باعث افزایش بیان آرژیناز در موشهای دیابتی میشود. در یک مطاله آزمایشگاهی، نقش P38 در تنظیم بیان آرژیناز و اختلال در تنظیم eNOS در سلولهای اندوتلیال تحت شرایط هایپرگلیسمی بررسی شد. این تحقیق گزارش کرد که آرژیناز و P38 در پاسخ به شرایط گلوکز بالا افزایش پیدا کردند. علاوه بر این استفاده از مهار MAP-kinases نشان داد P38 MAPK یک فعالکننده بالادست در یک آبشار سیگنالینگ است که به افزایش آرژیناز I در شرایط گلوکز بالا منجر میشود [
7]. همچنین چندین مطاله گزارش کردهاند که آرژیناز در کیفیت عضله، در پاتوفیزیولوژی میوبلاستها و پیری زودرس عضله که در افراد دیابتی اتفاق میافتد، نقش دارد. بنابراین مهار فعالیت آرژیناز ممکن است یک استراتژی درمانی مؤثر برای کاهش رتینوپاتی دیابتی با جلوگیری از پیری زودرس در بیماران دیابتی باشد [
8].
با توجه به عوارض زیاد دیابت، این بیماری به درمان مناسبی نیاز دارد. به نظر میرسد روشهای درمانی نظیر تمرین و فعالیت بدنی، تغذیه، داروهای خوراکی و انسولین برای درمان این بیماری مفید باشند [
9].
استفاده از گیاهان دارویی نسبت به بسیاری از داروهای شیمیایی عوارض کمتری دارد. یکی از این گیاهان که توجه بسیاری به آن شده دارچین است. دارچین خوراکی از ساقه یک درخت آسیایی به نام سیناموم ژیلانکیوم از گونه لوراسه است. مطالعات نشان دادهاند ادویهجات مانند دارچین، میخک، گردو، چای سبز و نعناع تأثیرات مشابهای بر عملکرد انسولین دارند و فعالترین آنها دارچین است [
10]. دارچین جذب گلوکز را از طریق فعال کردن گیرنده انسولینی افزایش میدهد [
11]. همچنین سنتز گلیکوژن، متابولیسم چربی [
11] و وضعیت آنتیاکسیدانی را بهبود میبخشد [
12].
مطالعات مختلف تأثیر داروهای گیاهی دارچین را در بیماران دیابتی بررسی کردهاند. برای مثال، حقیقت و همکاران اظهار کردند مصرف روزانه 1/5 گرم دارچین باعث بهبود فاکتورهای خونشناختی در بیماران مبتلا به دیابت نوع 2 میشود [
13]. مطالعات بیشتر نشان میدهد دارچین عملکرد انسولین را تقویت و مسیر AKT-eNOS را فعال میکند [
14]. بیون و همکاران گزارش کردند دارچین ازطریق مسیر Akt/PKB-eNOS و تعدیل نیتریکاکساید باعث شل شدن عروق در سلولهای اندوتلیال میشود (23/32). از طرف دیگر، چندین مطالعات بالینی و مدل تجربی گزارش کردند که آرژیناز از طریق مختل کردن مسیر تولید نیتریکاکساید، عوارض ناشی از دیابت را تشدید میکند [
10-6]. بنابراین میتوان امید داشت دارچین با کاهش فعالیت یا سطح آنزیم آرژیناز باعث کاهش عوارض ناشی از دیابت شود.
امروزه پژوهشگران عقیده دارند رژیم غذایی و دارویی بهتنهایی در درمان و کنترل قند بیماران دیابتی کافی نیست و انجام فعالیتهای ورزشی نیز باید به برنامه روزانه این دسته از افراد اضافه شود [
15]. نشان داده شده است که کاهش فعالیت بدنی و آمادگی هوازی، ارتباط مثبت و معناداری با میزان مرگومیر افراد مبتلا به دیابت دارد [
16]. عابدی و همکاران کاهش معنادار انسولین و مقاومت به انسولین را بهدنبال تمرینات سرعتیتناوبی گزارش کردند. این محققین معتقدند تمرینات ورزشی مستقل از نوع و روش انجام، اثرات مثبتی بر مقاومت به انسولین زنان مبتلا به دیابت نوع 2 دارند [
17]. در همین راستا تشکریزاده و مقرنسی در مطالعهای روی زنان دیابتی نوع 2، گزارش کردند که 10 هفته تمرین مقاومتی، سبب کاهش معناداری در گلوکز و مقاومت به انسولین میشود [
18]. همچنین بیات و همکاران در مطالعهای بر روی موشهای دیابتی نشان دادند تمرینات استقامتی در اختلالات متابولیک مرتبط با دیابت مؤثرتر است [
19].
فعالیت ورزشی استقامتی سطح پایه فعالسازی P38 را کاهش میدهد [
20]. با توجه به نقش آنزیم آرژیناز در شرایط گلوکز بالا و تأثیر ورزش و عصاره دارچین بر پروتئین بالادست این آنزیمها (یعنی P38 MAPK)، هدف از پژوهش حاضر پاسخ به این پرسش است که آیا تمرینات استقامتی همراه با عصاره دارچین میتواند آنزیم آرژیناز را در دیابت تعدیل کند؟ همچنین با در نظر گرفتن اینکه محتوای پروتئین عضلات کندانقباض نسبت به عضلات تندانقباض زودتر به تمرینات استقامتی واکنش نشان میدهد، در این پژوهش از عضله نعلی (کندانقباض) استفاده شده است.
مواد و روشها
روش مطالعه حاضر از نوع تجربی بود و کمیته اخلاق حیوانات دانشگاه علومپزشکی رازی آن را تأیید کرد (کد اخلاق: IR.MUK.REC.1398.5008). همچنین آزمایشات حیوانات مطابق با راهنمای مراقبت و استفاده از حیوانات آزمایشگاهی مؤسسه ملی بهداشت ایالات متحده (انتشار شماره 23 تا 85، اصلاح شده در 1996) انجام شد. در این پژوهش، 35 سر موش نر ویستار 8 هفتهای (200 تا250 گرم) از مرکز نگهداری حیوانات دانشگاه علومپزشکی لرستان بهطور تصادفی خریداری شدند. تمامی موشها در یک محیط عاری از عوامل بیماریزا مخصوص حیوانات با چرخه روشناییتاریکی 12:12 ساعت (روشنایی 7 تا 19، تاریکی 19 تا7) با دمای محیطی 1±24 سانتیگراد در گروههای سهتایی در قفسهای پلیکربنات شفاف نگهداری شدند. در طول مطالعه حیوانات به آب و غذای فشرده ویژه موش دسترسی آزاد داشتند. موشها بعد از 7 روز سازگاری با محیط جدید، القای دیابت و سازگاری با فعالیت ورزشی روی تردمیل مخصوص جوندگان، به روش تصادفی و براساس وزن به 5 گروه مساوی کنترل (n=7)، دیابت (n=7)، دیابت و مکمل (n=7)، دیابت و ورزش هوازی (n=7) و دیابت، ورزش هوازی و مکمل (n=7) تقسیم شدند.
القای دیابت نوع 2
در این روش موشها با استفاده از داروی نیکوتین آمید و استرپتوزوتوسین (شرکت سیگما، آمریکا) دیابتی شدند [
21]. ابتدا نیکوتین آمید (95 میلیگرم به ازای هر کیلوگرم وزن موش که در محلول سالین حل شد) بهصورت درونصفاقی تزریق شد و پس از 15 دقیقه، 55 میلیگرم بر کیلوگرم استرپتوزوتوسین که در محلول بافر سیترات 1/0 مولار با اسیدیته برابر 5/4 حل شده بود بهصورت درونصفاقی تزریق شد. برای تشخیص دیابتی بودن موشها، 5 روز پس از تزریق سطوح قند خون در موشهای صحرایی بهوسیله گلوکومتر (شرکت روشه، آلمان) اندازهگیری شد و قند خون 200 تا 400 میلیگرم بر دسیلیتر نشاندهنده دیابتی شدن آنها بود [
22].
پروتکل تمرینی
همه موشها یک هفته با شیب صفر و سرعت 5 متر در دقیقه، 5 دقیقه در روز جهت سازگاری روی تردمیل دویدند. سپس برنامه تمرینی هوازی 8 هفتهای بهصورت پیشرونده آغاز شد. این برنامه ورزشی براساس مطالعه چیا و همکاران و از شدت تمرینی متوسطی برخوردار است [
23]. گروههای ورزشی برای 5 جلسه در هفته و به مدت 8 هفته با تردمیل (آذرخش 5 لاین. شرکت مهندسی پیشرو اندیشه صنعت) تمرین کردند. سرعت و مدت تمرین نوار گردان بهتدریج افزایش یافت و شیب نوارگردان در طول تمرین صفر بود. 10 متر در دقیقه برای 10 دقیقه در هفته اول؛ 10 متر در دقیقه برای 20 دقیقه در هفته دوم؛ 15 متر در دقیقه برای 20 دقیقه در هفته سوم؛ 15 متر در دقیقه برای 30 دقیقه در هفته چهارم؛ 17 تا 18 متر در دقیقه برای 30 دقیقه در هفته پنجم؛ 17 تا 18 متر در دقیقه برای 40 دقیقه در هفته ششم، به 20 متر در دقیقه برای 40 دقیقه در هفته هفتم افزایش یافت. جهت رسیدن سازگاریهای بهدستآمده به حالت یکنواخت، تمامی متغیرهای تمرینی در هفته پایانی (هفته هشتم) ثابت نگه داشته شد (
جدول شماره 1).

موشها در گروهای دیابت و مکمل و دیابت، ورزش هوازی و مکمل 8 هفته روزانه mg/kg 200 مکمل دراچین را بهصورت گاواژ دریافت کردند و موشهای گروه دیابت و ورزش هوازی و دیابت در این مدت دارونما (آب) دریافت کردند [
24].
روش تهیه عصاره هیدروالکلی دارچین
بعد از تهیه گیاه دارچین از عطاری معتبر و تأیید کارشناسان آزمایشگاه، عصاره دارچین در مرکز تحقیقات گیاهان دارویی دانشگاه علومپزشکی لرستان استخراج شد. ابتدا چوب گیاه دارچین با استفاده از دستگاه آسیاب پودر شد و در 20 سیسی الکل اتیلیک طبی 96 درصد حل شد. سپس مخلوط 24 ساعت در دمای اتاق (25 درجه سانتیگراد) نگهداری شد و در ادامه ترکیب حاصل با استفاده از دستگاه همزن مغناطیسی 4 دقیقه کاملاً مخلوط و بر روی یک کاغذ واتمن که وزن اولیه آن یادداشت شد، صاف شد. کاغذ و پودر باقیمانده بر روی آن در دستگاه آون با حرارت 50 درجه سانتیگراد 1/5 ساعت خشک شد. با اختلاف وزن پودر خشک باقیمانده بر روی کاغذ صافی و مقدار اولیه دارچین میزان پودر حلشده مشخص شد. عصاره استخراجشده به این روش حاوی مقدار زیادی الکل (20 میلیلیتر) بود. جهت حذف الکل، عصاره 48 ساعت در محیط عاری از آلودگی قرار گرفت تا الکل اضافه تبخیر شود. سپس عصاره تهیهشده جهت مصرف موشها در محلول کربوکسی متیل سلولز cmc) 5 درصد) حل شد [
25].
آمادهسازی بافت
تمامی موشها 48 ساعت پس از آخرین جلسه تمرین، با تزریق درونصفاقی کتامین (آلفاسان، هلند) (mg/kg 60) و زایلازین (Bioveta، جمهوری چک) (mg/kg 10) بیهوش شدند. سپس همراه با متخصصین جراحی، عضله نعلی جدا شد. ابتدا بافت با محلول بافر PBS جهت خارج کردنِ خونِ اضافه، شستوشو و بافت وزن شد. در مرحله بعد، بافت در یک ظرف حاوی یک میلیلیتر بافر لیزکننده قرار داده شد و ظرف در یخ قرار داده شد. مخلوط حاصل بهوسیله سونیکیت بهخوبی هموژن شد. مخلوط هموژنه در g 10000 5 دقیقه سانتریفیوژ شد و محلول رویی جهت سنجش بلافاصله برای تجزیهوتحلیلهای بعدی در دمای منفی 80 درجه نگهداری شد.
تعیین مقدار آرژیناز و P38 MAPK در عضله نعلی
مقادیر آرژیناز و P38 MAPK بهوسیله کیتهای الایزا (آرژیناز: حساسیت: 0/078 نانوگرم / میلیلیتر، دامنه تشخیص: 20 تا 0/312 نانوگرم/میلیلیتر؛ P38 MAPK: حساسیت: 0/75 نانوگرم / میلیلیتر، دامنه تشخیص: 80 تا 1/25 نانوگرم / میلیلیتر، کازابایو، ژاپن) براساس دستورالعمل شرکت مربوط اندازهگیری شدند.
تحلیل آماری
دادهها بهصورت میانگین و انحراف معیار گزارش شدهاند. نتایج آزمون شاپیرو ویلک نشان داد دادهها از توزیع طبیعی برخوردارند. بنابراین، بهمنظور مقایسه بینگروهی از آزمون آنالیز واریانس یکطرفه و در ادامه از آزمون تعقیبی توکی استفاده شد. همچنین بهمنظور بررسی روابط بین متغیرها از آزمون ضریب همبستگی پیرسون در سطح معناداری 0/05>P استفاده شد. تمام محاسبات آماری با استفاده از نرمافزار آماری SPSS نسخه 24 انجام شد.
یافتهها
تغییرات وزن بدن
موشها در گروههای دیابت و تمرین هوازی و دیابت، تمرین هوازی و مکمل بهطور مستمر پروتکل 8 هفتهای تمرین استقامتی را انجام دادند. نتایج آنالیز واریانس نشان داد میانگین وزن موشها پیش از شروع پروتکل دارای اختلاف معنیداری نبود (F=0/948 و P=0/45). اما در پسآزمون وزن موشها در گروههای دیابت، دیابت و تمرین هوازی، دیابت و مکمل و دیابت، تمرین هوازی و مکمل نسبت به گروه کنترل کاهش معناداری داشت (0/00005=P). بعلاوه، وزن موشها در گروههای دیابت و مکمل (0/02=P) و دیابت، تمرین هوازی و مکمل (0/00005=P) نسبت به گروه دیابت افزایش معناداری داشت، اما بین گروه دیابت با گروه دیابت و تمرین هوازی (0/49=P)، گروه دیابت و مکمل با دیابت، تمرین هوازی و مکمل (0/49=P) و دیابت و تمرین هوازی با دیابت و مکمل (0/49=P) اختلاف معناداری وجود نداشت (
جدول شماره 2).

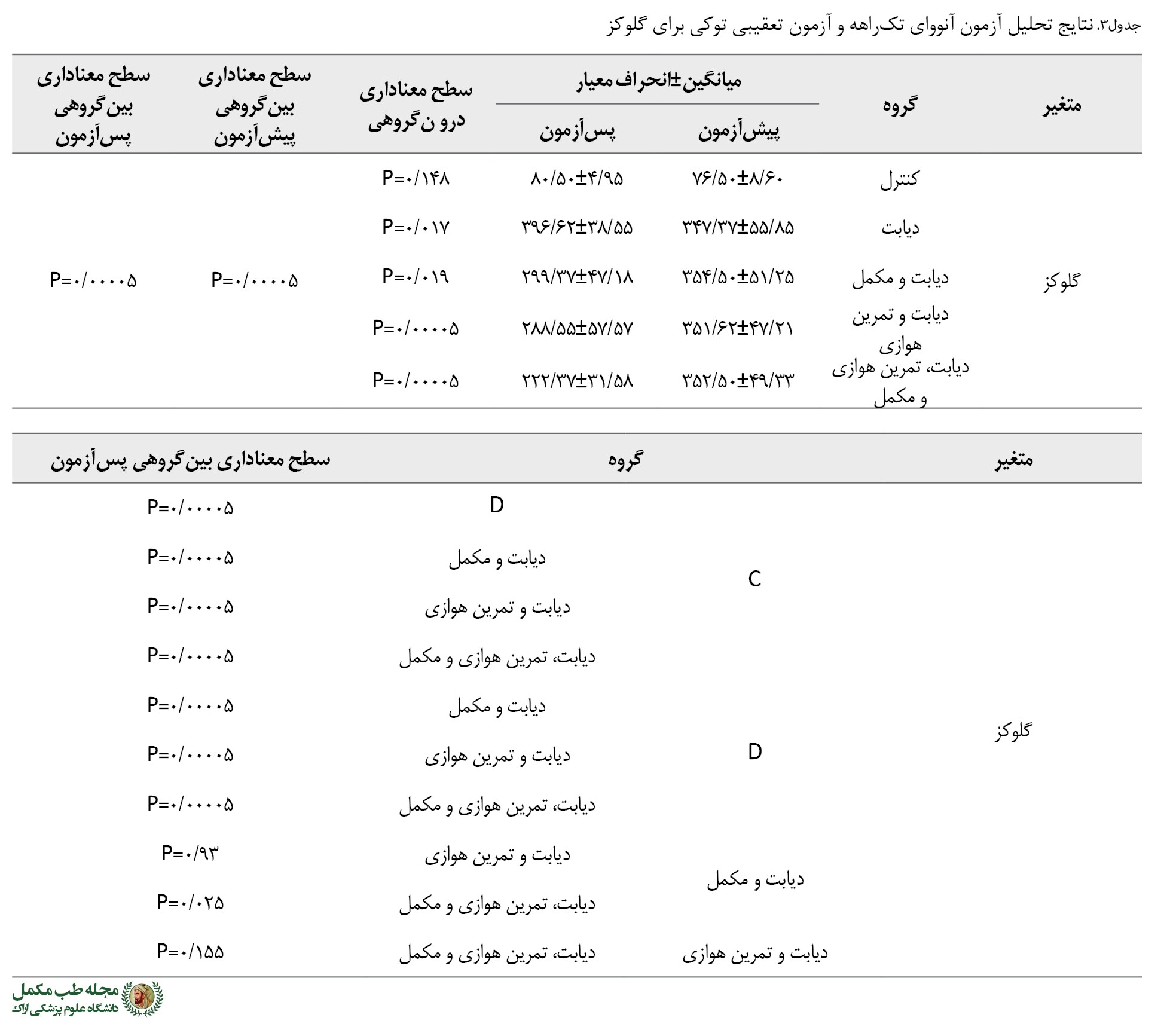
تغییرات غلظت گلوکز خون
با اندارهگیری گلوکز خون، مشخص شد موشها 48 ساعت پس از تزریق استرپتوزوتوسین، دچار هایپرگلیسمی شدند و پیش از شروع پروتکل تمرینی، غلظت گلوکز خون گروههای دیابتی بهطور معنیداری بالاتر از گروه کنترل بود (0/00005=P). بههرحال، در پس آزمون غلظت گلوکز گروههای دیابت و تمرین هوازی (0/00005=P)، دیابت و مکمل (0/00005=P) و دیابت، تمرین هوازی و مکمل (0/00005=P) در مقایسه با گروه دیابت بهطور معنیداری کمتر بود. همچنین غلظت گلوکز خون گروههای دیابت و مکمل و دیابت، تمرین هوازی و مکمل با هم تفاوت معنادار داشت (0/025=P). علاوه بر این تفاوت معناداری بین گروههای دیابت و مکمل و دیابت و تمرین هوازی (0/93=P) و دیابت و تمرین هوازی و دیابت، تمرین هوازی و مکمل (0/1550=P) وجود نداشت (
جدول شماره 3).
تغییرات سطوح پروتئین آرژیناز
تحلیل آماری نشان داد سطوح پروتئین آرژیناز در گروههای دیابت (0/00005=P)، دیابت و مکمل (0/00005=P) و دیابت و تمرین هوازی (0/00005=P) نسبت به گروه کنترل به شکل معناداری بالاتر است. همچنین، سطوح پروتئین آرژیناز در گروه دیابت، تمرین هوازی و مکمل نسبت به گروههای دیابت (0/00005=P)، دیابت و مکمل (0/00005=P) و دیابت و تمرین هوازی (0/00005=P) به شکل معناداری کمتر بود (05/0>P). از سوی دیگر، بین دو گروه کنترل و دیابت، تمرین هوازی و مکمل اختلاف معنیداری وجود نداشت (0/097=P) (
تصویر شماره 1).
.jpg)
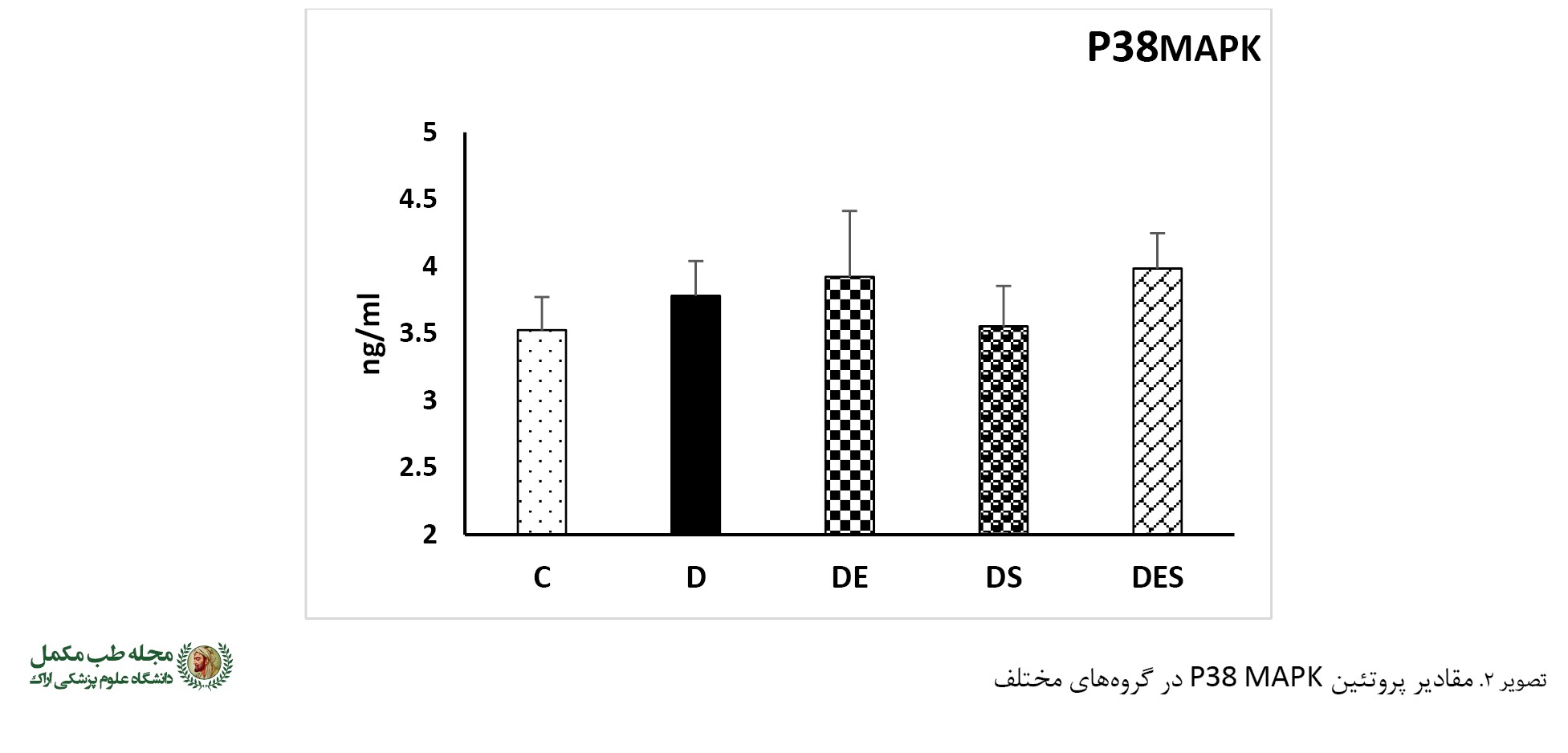
تغییرات سطوح پروتئین P38 MAPK
تحلیل آماری نشان داد اختلاف معناداری بین سطوح پروتئین P38 MAPK در بین گروها وجود نداشت (F=2/282 و P=0/07) (
تصویر شماره 2).
همبستگی بین متغیرها
نتایج آزمون ضریب همبستگی پیرسون نشان داد بین 2 متغیر آرژیناز و سطح گلوکز خون همبستگی مثبت و معناداری وجود دارد (r=0/547 و P=0/0005). اما بین سطوح پروتئین p38 MAPK و سطوح گلوکز خون (r=0/096 و P=0/556)، همچنین بین سطوح پروتئین P38 MAPK و پروتئین آرژیناز همبستگی وجود نداشت (r=0/213 و P=0/187).
بحث
نتایج مطالعه حاضر نشان داد غلظت گلوکز خون در گروههای دیابت و تمرین هوازی، دیابت و مکمل و دیابت، تمرین هوازی و مکمل نسبت به گروه دیابت کاهش معناداری دارد. همسو با این نتایج، فیاض و همکاران نشان دادند سه روش تمرین استقامتی، دارچین و ترکیب دارچین و ورزش باعث کاهش معنادار سطح گلوکز خون میشود [
26]. مقایسه غلظت گلوکز خون بین سه گروه دیابت و تمرین هوازی، دیابت و مکمل و دیابت، تمرین هوازی و مکمل نشان داد فقط بین گروه دیابت و مکمل و دیابت، تمرین هوازی و مکمل به نفع گروه دیابت، تمرین هوازی و مکمل اختلاف معناداری وجود دارد. به نظر میرسد که مصرف عصاره دارچین و ورزش هوازی تأثیر مثبتی بر روی قند خون نمونههای دیابتی دارند، اما ترکیب عصاره دارچین و ورزش تأثیر مضاعفی دارد. این نتایج با تحقیق مؤمنی و همکاران همخوانی ندارد که نشان دادهاند بین سه گروه ورزش، دارچین و ترکیب دارچین و ورزش در کاهش قند خون تفاوت معناداری وجود ندارد. هرچند در مطالعه آنها گزارش شده که در میزان انسولین ناشتای خون بین دو گروه مصرف دارچین و ترکیبی به نفع گروه ترکیبی اختلاف معناداری وجود داشت [
27]. این اختلاف نتایج میتواند بهدلیل نوع آزمودنیها، مقدار مصرف دارچین و پروتکلهای تمرینی متفاوت باشد. برای مثال در پژوهش حاضر نمونهها موشهای دیابتی بودهاند، اما در پژوهش فیاض و همکاران نمونهها مردهای دیابتی بودهاند. بههرحال، مطالعات نشان دادهاند تمرینات ورزشی باعث کاهش معنادار گلوکز خون و مقاومت به انسولین میشوند [
30-28 ،
17]. بهعلاوه، مطالعات بر روی موشهای دیابتی نشان داده است مصرف عصاره دارچین موجب بهبود شاخصهای قندی و انسولینی میشود [
32 ،31].
همچنین نتایج تحقیق حاضر نشان داد که سطح آنزیم آرژیناز در موشهای گروه دیابت در مقایسه با موشهای گروه کنترل بهطور معناداری بیشتر است. نقش آرژیناز در عوارض دیابت بهخوبی ثابت شده است و بهطور گسترده بررسی شده است [
34 ،33]. مطالعات بر روی بیماران دیابتی، افزایش بیان آرژیناز همراه با اختلال در شل شدن عروق کرونر را نشان داده است [
3]. مهار فعالیت آرژیناز موجب کاهش اختلالات ناشی از سطوح بالای گلوکز میشود. همچنین نشان داده شده که آرژیناز در آسیب کاردیومیوسیتهای ناشی از دیابت نقش دارد [
35].
در مطالعهای با بررسی آئورت موشهای دیابتی، نشان داده شد که با مهار کردن آنزیم آرژیناز بهطور قابلتوجهی در برابر اختلالات ناشی از شل شدن عروق وابسته به اندوتلیال و سفتی عروق محافظت میشود [
36]. همچنین بیشبیانی آرژیناز در سایر عوارض دیابت نوع 1 و 2، ازجمله پیری زودرس عضله، نوروپاتی و اختلال نعوظ دخیل است [
37-39]. تنظیم بیشبیانی آرژیناز نیز بهشدت در اختلالات عروقی و متابولیک محیطی در مدل موش چاقی ناشی از رژیم غذایی غربی و دیابت نوع 2 دخیل است. حذف یا مهار دارویی فعالیت بالای آرژیناز، اختلالات ناشی از چاقی در استرس اکسیداتیو و اختلال در شل شدن وابسته به اندوتلیال را کاهش میدهد [
40].
در تحقیق حاضر برای اولین بار عوامل خارجی مؤثر بر آنزیم آرژیناز در موجودات زنده بررسی و نشان داده شد سطح آنزیم آرژیناز تنها در گروه دیابت، تمرین هوازی و مکمل نسبت به گروه دیابت کاهش معناداری پیدا کرد، این کاهش به میزانی بود که بین گروه کنترل و گروه دیابت، تمرین هوازی و مکمل در سطح آنزیم آرژیناز اختلاف معنیداری وجود نداشت. درواقع ترکیب ورزش و دارچین توانست آرژیناز را که در دیابت افزایش یافته بود، کاهش دهد و به نزدیکی گروه سالم برساند. دادههای درحال ظهور نشان میدهند تنظیم مجدد آرژیناز عامل مهمی در کاهش قابلیت فراهمی زیستی نیتریکاکساید بهدلیل رقابت آن با eNOS برای سوبسترای مشترک L-arginine است [
34]. مهار یا کاهش آرژیناز، انفارکتوس را کاهش داده و باعث خونرسانی به میوکارد قلب میشود [
42 ،41].
مهار یا کاهش آرژیناز نشاندهنده راهکاری برای جلوگیری از پیری زودرس ناشی از دیابت با حفظ فراهمی زیستی نیتریکاکساید است [
43]. در موشهای دیابتی اختلال عملکرد اندوتلیال همراه با اختلال در مسیر AKT-eNOS است که با افزایش آنزیم آرژیناز همراه است. از طرف دیگر، مصرف دارچین در موشهای دیابتی باعث تقویت مسیر AKT-eNOS میشود. ازآنجاییکه سوبسترای آنزیم eNOS و آنزیم آرژیناز یکسان است و این دو آنزیم همانند دو کفه ترازو عمل میکنند به نظر میرسد مصرف دارچین کفه ترازو مسیر AKT-eNOS را سنگینتر کرده و باعث کاهش سطح آنزیم آرژیناز میشود که پیامد آن کاهش عوارض دیابت است.
همچنین در این پژوهش نشان داده شد که بین هیچیک از گروهها در سطح پروتئین P38 اختلاف معناداری وجود نداشت. این در حالی بود که آنزیم آرژیناز در گروه دیابت، تمرین هوازی و مکمل بهطور معناداری کاهش یافت و هیچگونه همبستگی بین P38 و آنزیم آرژیناز وجود نداشت. این نتایج نشان میدهد که آنزیم آرژیناز مستقل از P38 میتواند تعدیل شود. در مقابل، مزروعی و همکاران گزارش کردهاند آنزیم آرژیناز بهواسطه P38 تعدیل میشود. این اختلاف میتواند بهدلیل شرایط متفاوت پژوهش باشد، زیرا پژوهش مزروعی و همکاران در شرایط آزمایشگاهی، اما پژوهش حاضر با موشهای دیابتی انجام شد. مطالعات درمورد اثر دارچین بر پروتئین P38 نتایج ضدونقیضی را نشان میدهد. برای مثال، شوئن و همکاران و جین و همکاران کاهش در سطح فعالیت پروتئین P38 را بهدنبال درمان با عصاره دارچین گزارش کردهاند [
45 ،44]. درحالیکه چونگ و همکاران افزایش پروتئین P38 را بهدنبال درمان با عصاره دارچین گزارش کردند [
45]. این نتایج راجع به تأثیرات روی فسفوریلاسیون P38 ممکن است بهدلیل برهمکنشهای مختلف MAP Kinase در انواع مختلف سلولها، فقدان قابلیت انتقال بین سنجشهای مبتنی بر کشت سلولی انجامشده و مدلهای موش، زمان انکوباسیون یا غلظت عصاره باشد. بههرحال، اظهارنظر کلی در این مورد به پژوهشهای بیشتری نیاز دارد.
نکته قابلتوجه در تحقیق حاضر وجود همبستگی مثبت و معنادار بین گلوکز خون و آنزیم آرژیناز بود. در مطالعات مختلف اما در شرایط آزمایشگاهی و در سلولهای کشت آزمایشی به رابطه بین شرایط گلوکز بالا و آنزیم آرژیناز پرداختهاند. برای بررسی تأثیر این فرایند سلولهای کشت را در غلظت های گلوکز مختلف شامل 12/5، 15، 22/5، 25 و 30 میلیمولار و در زمانهای مختلف قرار دادهاند که افزایش فعالیت و سطح پروتئین آرژیناز I را در سلولهای در معرض گلوکز بالا گزارش کردهاند (25 میلیمولار، 24 ساعت) [
4]. این رابطه بین آرژیناز و غلظت گلوکز اهمیت افزایش بیان آرژیناز I را بهعنوان یک واسطه تعیینکننده در پاتوژنز اختلال عملکرد عروقی در دیابت در پاسخ به افزایش قند خون نشان میدهد. مطالعات قبلی گزارش کرده بودند فعالیت آرژیناز در پاتولوژی دیابت نقش دارد [
47، 46،
5].
نتیجهگیری
ترکیب ورزش و عصاره دارچین میتواند سطح آنزیم آرژیناز را کاهش دهد. با توجه به مرتبط بودن بسیاری از عوارض دیابت با افزایش آنزیم آرژیناز، این روش درمانی میتواند بسیار کمککننده باشد.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مقاله مورد تایید کمیته اخلاق دانشگاه کردستان قرار گرفته است (کد: IR.MUK.REC.1398.5008).
حامی مالی
این مقاله حاصل رساله دکتری نویسنده اول در گروه فیزیولوژی ورزشی دانشگاه لرستان است که با حمایت معاونت پژوهشی دانشگاه انجام شده است.
مشارکت نویسندگان
مفهومسازی، روششناسی، بررسی، منابع، نگارش - تهیه پیش نویس اصلی، نگارش - بررسی و ویرایش، تجسم، نظارت، مدیریت پروژه: احسان حسینینژاد و وحید ولیپور دهنو. مفهومسازی، روششناسی، نگارش - بررسی و ویرایش، تصویرسازی، نظارت: احسان قهرمانلو؛ نرم افزار، اعتبار سنجی، تحلیل رسمی، تحقیق، منابع، گردآوری داده ها، نگارش - بررسی و ویرایش، تجسم: علی گرزی.
تعارض منافع
هیچ گونه تعارض منافعی از سوی نویسندگان گزارش نشده است.



.jpg)

