مقدمه
کافئین یا 1،3،7-تریمتیلگزانتین، آلکالوئیدی دارای دو حلقه اتصالی پیریمیدین دیون و ایمیدازول است و به عنوان یک سوبسترای زنوبیوتیکی به طور منظم در رژیم غذایی روزانه اقشار مختلف جامعه مورد استفادههای گوناگون قرار میگیرد [
1]. بهخوبی نشان داده شده است که کافئین دارای دامنه گستردهای از ویژگیهای فیزیولوژیک و فارماکولوژیک است. با این حال، کافئین در مواجهه با شرایط پاتولوژیک میتواند همچون یک تیغ دولبه عمل کند؛ به این صورت که از طرفی، فعالکننده مسیرهای پیامرسانی بقا و محافظتکنندگی سلولی بوده و از سویی دیگر القاکننده مسیرهای مرگ سلولی است [
2،
3]. این چنین پیشنهاد میشود که کافئین ممکن است بر عملکرد بافتی اثر گذاشته و تعدیلکننده چرخه زندگی ـ مرگ سلولی باشد [
4]. در راستای این مفهوم، یافتههای مطالعات ناکاسو و همکاران [
5] و وانگ و لو [
6] به ترتیب نشاندهنده اثرات حفاظتی کافئین بر جلوگیری از مرگ سلولی آپوپتوتیک در سلولهای نورونی مُدل پارکینسونی و قرارگیری در معرض تابش اشعه UV در سلولهای اپیتلیالی هستند. در حالی که نتایج پژوهش لیو و همکاران حاکی از پتانسیل ضدسرطانی کافئین به علت توانایی آن در سرکوب تکثیر سلولی و القاکننده آپوپتوز از طریق کاهش در بیان پروتئین Bcl-2 و افزایش در بیان پروتئین Bax در سلولهای معده انسانی است [
7]. همچنین لیو و همکاران اظهار داشتند که انکوباسیون سلولهای سرطانی معده انسان در حضور کافئین باعث فعالسازی پروتئینهای آپوپتوزی کاسپاز-3 و 9 از طریق چندین مسیر آنکوژنیک شامل هومولوگ فسفاتاز تنسین (PTEN)، PI3-k/Akt، p53 و mTOR میشود [
7].
آپوپتوز، فرایندی فیزیولوژیک و برگشتپذیر است که به کمک آن میزان رشد و تکثیر سلولهای بدن تنظیم شده و از ایجاد انواع بدخیمیها جلوگیری به عمل میآید و سبب برقراری هوموستاز سلولی میشود. این در حالی است که اختلال در ماشین آپوپتوزی منجر به ایجاد بیماریهای مختلفی از قبیل بیماری خودایمنی، سرطان، مقاومت تومور به دارو و دیابت میشود[
8،
9] . دیابت یکی از بیماریهای شایع در ایران و جهان به شمار میرود، به طوری که در سال 2017 از هر یازده نفر انسان بالغ یک نفر در جهان مبتلا به این بیماری بوده و در هر 8 ثانیه جان یک نفر را گرفته است. در این بین چنین عنوان شده است که آپوپتوز ناشی از دیابت مهمترین عامل ایجاد بیماریهای قلبی - عروقی در افراد دیابتی بهویژه نقص در عملکرد بافت میوکارد به علت کاهش در انعطافپذیری عضله قلبی است که به اصطلاح کاردیومیوپاتی دیابتی (DCM) نامیده میشود [
10]. به عنوان مثال، فانو ـ یوانگ و همکاران به دنبال تجزیه و تحلیل وسترنبلات شاخصهای آپوپتوتیک در موشهای مبتلا به کاردیومیوپاتی مزمن، کاهش در عملکرد عضله قلبی همراه با کاهش در بیان پروتئین Bcl-2 و افزایش در بیان Bax و کاسپاز-3 را نشان دادند [
11]. این در حالی است که شواهد روبهرشدی پیشنهادکننده این موضوع هستند که فرایندهای آپوپتوتیک چندین پروتئین محوری شامل Bax و Bcl-2 را تنظیم میکنند که هر دو دارای نقش اساسی در فعال شدن مسیرهای پیامرسانی داخلی آپوپتوز هستند [
12]. در واقع، پروتئین Bcl-2 (حفظ یکپارچگی غشای میتوکندری) یک عامل ضدآپوپتوزی است که در مسیر داخلی آپوپتوز نقش داشته و مانع از فعالیت کاسپازها میشود. در این بین، پروتئین پیشآپوپتوتیکی Bax (کاهش در پایداری غشای خارجی میتوکندری) نیز عاملی است که با خنثی کردن فعالیت Bcl-2، مسیر آپوپتوزی را فعال کرده و سبب تغییرات بافتشناختی همچون کاهش یا عدم چسبندگی سلول آپوپتوزی به سلول دیگر، قطعهقطعه شدن DNA، آزادسازی ریبوزومها و تجزیه سلول به اجسام آپوپتوزی میشود و سلول در حال مرگ را ایجاد میکند. بنابراین افزایش در میزان Bax باعث افزایش وقوع آپوپتوز و مرگ سولی و کاهش آن منجر به بقای سلولی و ترمیم میشود. بالعکس، افزایش در سطوح Bcl-2 در جهت بقا و ترمیم سلولی بوده و آپوپتوز را مهار میکند؛ بنابراین سنجش نسبت Bax/Bcl-2 در تعیین اینکه آیا سلول زنده میماند یا میمیرد حیاتی است [
12،
13].
از این رو، تحقیق حاضر با توجه به وجود یافتههای محدود و متناقض در ارتباط با تأثیر تجویز دو ماه مکمل کافئین (70 میلیگرم در وزن بدن در روز) بر بیان پروتئینهای کلیدی مسیر میتوکندری آپوپتوز یعنی Bax و Bcl-2 و نسبت آنها بر یکدیگر در بافت سوماتیک حساس به مرگ سلولی میوکارد (بطن چپ) متعاقب القای دیابت در موشهای نر ویستار صورت پذیرفت.
مواد و روشها
آزمودنیها
تحقیق حاضر از نوع مطالعات تجربی با طرح پیشآزمون و پسآزمون با گروه کنترل است. در این تحقیق 24 سر موش صحرایی نر سفید نژاد ویستار با سن 10 هفته و در محدوده وزنی 300-250 گرم به روش در دسترس خریداری و در آزمایشگاه حیوانی دانشگاه علومپزشکی تبریز (مرکز تحقیقات علوم اعصاب) در محیط آزمایشگاهی ویژه حیوانات در اتاقی به ابعاد 3 در 4 متر با دارا بودن شرایط دمایی 3±22 درجه سانتیگراد، رطوبت نسبی 5±50 درصد، با کمترین سروصدا و چرخه روشنایی ـ تاریکی 12:12 ساعته (شروع روشنایی از ساعت 7:00 صبح الی 19:00 عصر) نگهداری شدند. در سراسر دوره تحقیق (فصل بهار)، تمامی حیوانات به صورت آزادانه به آب و غذای استاندارد حیوانی به مدت سه ماه دسترسی داشتند. آزمودنیها پس از مطابقت وزنی به صورت تصادفی ساده در یکی از سه گروه 8 سری شامل گروه کنترل سالم (C)، گروه کنترل دیابتی (D) و گروه دیابتی دریافتکننده کافئین (D+CA) قرار گرفتند (
جدول شماره 1).
.jpg)
مدتزمان مطالعه (هشت هفته) در تحقیق حاضر طبق مطالعات موجود، برای برقراری سازگاری بلندمدت در آزمودنیها در مطالعات کارآزمایی بهخوبی ثابت شده است.
القای دیابت
پس از دو هفته سازگاری با محیط جدید، برای القای دیابت نوع 2 طبق روش گروه مطالعاتی ساسیدهاران و همکاران، به مدت دو هفته غذای پُرچرب (45 درصد چربی، 21 درصد پروتئین و 34 درصد کربوهیدرات) که توسط محققان و با همکاری شرکت خوراکسازان اصفهان تهیه شده بود داده شد و سپس تزریق درون صفاقی (IP) سم استرپتوزوسین (ساخت شرکت Sigma-Aldrich، ایالات متحده) در یک دُز 35 میلیگرم در کیلوگرم وزن بدن، حلشده در بافر سیترات 0/1 مولار (4/5=PH) بعد از 6 ساعت ناشتایی بهصورت تکوهلهای اعمال شد [
14]. برای ایجاد شرایط کاملاً یکسان با گروههای دریافتکننده مکمل، به گروه کنترل سالم و دیابتی (بدون مکمل) نیز همان مقدار سرم فیزیولوژیک (سالین) تزریق شد. 48 ساعت پس از روش دیابتی کردن، سطوح پلاسمایی گلوکز از ورید دُمی حیوان جمعآوری و مقدار آن با روش آنزیمی گلوکز اُکسیداز و با استفاده از دستگاه اسپکتروفتومتری (مدل 2100، ساخت شرکت UNIKO، ایالات متحده) اندازهگیری شد و غلظت گلوکز خون بالاتر از 300 میلیگرم در دسیلیتر به عنوان موشهای صحرایی دیابتی نوع 2 وارد تحقیق شدند.
نحوه تجویز مکمل کافئین
کافئین به شکل پودر کافئین خالص اِنهیدروز (خشک) تهیهشده از شرکت آلمانی Merck با شماره مجوز 2518359435571020 از سازمان غذا و دارو، پنج روز در هفته به مدت هشت هفته با توجه به وزن بدن حیوانات (70 میلیگرم در وزن بدن در روز با توجه به متوسط دُز کشنده برابر با 190 میلیگرم بر کیلوگرم برای موش) به طور کافئین هیدراته (محلول در یک سیسی سرم فیزیولوژیک) به صورت تزریق درون صفاقی توسط سرنگ انسولین تجویز شد (تقریباً برابر با 14 میلیگرم کافئین به ازای هر 200 گرم از وزن بدن موش). تجویز کافئین در دوره بیدار شدن موشها از خواب و اوایل زمان فعالیت آنها در محدوده زمانی ساعت 20-19 عصر تجویز شد. در ضمن ذکر این نکته ضروری است که براساس نتایج مطالعات موجود، تجویز 70 میلیگرم در وزن بدن موشها (همچون تحقیق حاضر) بسیار شبیه به غلظتهایی است که پس از مصرف چهار تا پنج فنجان قهوه به صورت روزانه در آزمودنیهای انسانی مورد استفاده قرار میگیرد [
15،
16].
روش نمونهبرداری
تمامی موشهای صحرایی، 48 ساعت پس از آخرین مداخله (جهت از بین بردن اثرات حاد) و پس از 12 تا 14 ساعت ناشتایی، با تزریق داخل صفاقی کتامین (90 میلیگرم بر کیلوگرم) ساخت شرکت Rotexmedica آلمان و زایلازین (10 میلیگرم بر کیلوگرم) ساخت شرکت Alfasan هلند به روش بدون درد توسط متخصصین کارآزموده بیهوش و جراحی شدند. سپس بخشی از بافت قسمت آپکس (رآس) بطن چپ آزمودنیها با دقت برداشته شده و پس از شستشو با سرم فیزیولوژیک در کرایوتراپ نیتروژن مایع ( منهای 196 درجه سانتیگراد) منجمد و در دمای منهای 70 درجه سانتیگراد در فریزر (دو درب ساخت شرکت دانش پژوهش فجر، تهران، ایران) نگهداری شد. در ادامه نیز برای ارزیابی میزان بیان پروتئین درگیر در مسیر آپوپتوز یعنی Bax و Bcl-2 از روش وسترنبلات استفاده شد [
17]. ابتدا برای تهیه هموژنه 10 درصد وزنی حجم بافت قلب از بافر ریپا (شرکت سیگما) حاوی مهارکننده پروتئاز کوکتیل (سیگما) استفاده شد. غلظت تام پروتئین با روش برادفورد (سیگما) مورد سنجش قرار گرفت. سپس پروتئین مورد نظر در ژل 10 درصد دناتورهکننده پلیآکریلآمید حاوی سدیم دودسیل سولفات (SDS) با دستگاه الکتروفورز (شرکت Bio Rad، ایالات متحده) تفکیک شد. بعد از تفکیک، باندهای پروتئینی روی غشای پلیوینیلیدین دیفلوراید (PVDF) (سیگما) انتقال یافت. بعد از استفاده از بافر بلاکینگ برای پوشش دادن نواحی خالی از پروتئین غشا از آنتیبادی اولیه خرگوشی ضد Bax و Bcl-2 ساخت شرکت سانتاکروز ایالات متحده به ترتیب با کُد sc-7480 و sc-492 به نسبت 1 به 500 (در طول شب) استفاده شد. غشاها پس از چهاربار شستوشو هربار به مدت 5 دقیقه با بافر فسفات نمکی حاوی 0/05 درصد توین 20، در معرض آنتیبادی ثانویه کونژوگه با Hrp بهمدت یک ساعت قرار گرفتند. پس از شستشوی مجدد با روش قبلی، اینبار به صورت سه تکرار از کیت ECL،BioRad که برای آشکارسازی مجموعههای ایمنی تشکیل شده استفاده شد. غشاها در معرض فیلم رادیوگرافی قرار گرفتند و دانسیته باندها توسط نرمافزار Image J نسخه 1/8/0/112 اندازهگیری و دانسیته باندهای پروتئین هدف در مقابل لودینگ کنترل بتا- اکتین نرمالیزه شدند. در انتها نیز نتایج به صورت دانسیته نسبی (نسبت به گروه کنترل) ارائه شدند [
17].
تجزیه و تحلیل آماری
توزیع طبیعی دادهها با استفاده از آزمون کلموگروف - اسمیرنوف بررسی شد. پس از تأیید توزیع طبیعی دادهها و با توجه به هدف تحقیق، نخست پیشفرض تحقیق مبنی بر تفاوت معنیدار گروه تجربی با گروه کنترل با استفاده از آزمون تی مستقل بررسی و سپس اثرات جداگانه و همزمان متغیر مستقل (مکمل کافئین) روی متغیرهای وابسته در قالب یک طرح آماری توسط آزمون تحلیل واریانس (ANOVA) یکطرفه و آزمون تعقیبی توکی مورد تجزیه و تحلیل قرار گرفت. تمامی عملیات آماری در سطح معنیداری برابر و کمتر از 0/05 و با استفاده از نرمافزار آماری SPSS نسخه 22 تحت ویندوز انجام شد. نمودارها و جداول نیز با استفاده از نرمافزار Excel رسم شدند.
یافتهها
نتایج تحقیق حاضر نشاندهنده وجود تفاوت معنیدار بین گروههای تجربی مصرفکننده مکمل کافئین بود (0/001=F=63/76 ,P). چنانکه بیان پروتئین Bax نسبت به B-Actin در دو گروه تجربی یعنی کنترل دیابتی در حدود 80 درصد (0/001=P) و در گروه دیابتی مصرفکننده مکمل در حدود 112 درصد (0/001=P) در مقایسه با گروه کنترل سالم افزایش یافت. ضمن اینکه گروه مکمل کافئین توانست با اثرات تشدیدکنندگی خود بیان پروتئین Bax را 32 درصد در مقایسه با گروه کنترل دیابتی افزایش دهد که از نظر آماری معنیدار نبود (0/83=P) (
تصویر شماره 1).
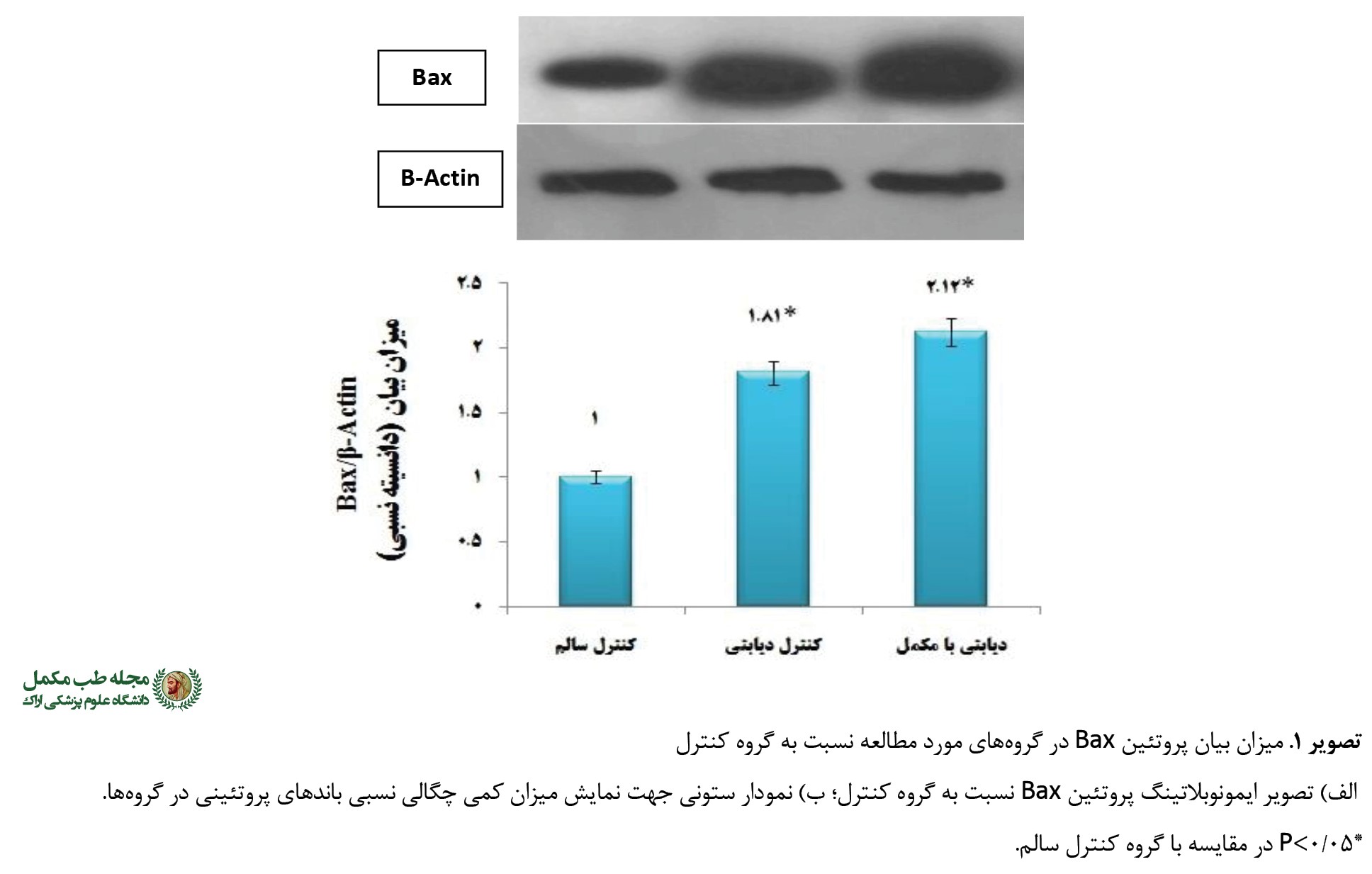
به علاوه، میزان بیان دیگر شاخص آپوپتوزی مورد مطالعه یعنی پروتئین Bcl-2 در هر دو گروه تجربی (دیابت و کافئین) نسبت به گروه کنترل سالم کاهش معنیداری داشت (0/001=F=42/31, P). به طوری که ابتلا به دیابت باعث کاهش قابل توجه 64- درصد در بیان پروتئین ضدآپوپتوزی Bcl-2 شد (0/001=P). این در حالی بود که تجویز کافئین در گروه دیابتی موجب پاسخ کاهشی به مراتب بیشتری (70- درصد) در مقایسه با گروه کنترل سالم شد (0/001=P) (
تصویر شماره 2).
همچنین با بررسی نسبت Bax/Bcl-2، افزایش معنیداری در دو گروه تجربی در مقایسه با گروه کنترل سالم مشاهده شد (0/001=F=48/35, P). در این بررسی گروه دیابتی دریافتکننده کافئین توانست سبب افزایش هرچه بیشتر در نسبت فعالیت آپوپتوزی در مقایسه با گروه کنترل دیابتی به میزان 73 درصد شود (0/003=P) (
تصویر شماره 3).

بحث
در مطالعه حاضر، القای دیابت نوع 2 در موشها سبب کاهش معنیدار بیان پروتئین Bcl-2، افزایش بیان پروتئین Bax و درنتیجه افزایش قابل توجه در ایجاد آپوپتوز و نیز افزایش در نسبت Bax/Bcl-2 شد. به علاوه، نتایج نشان داد تجویز مکمل کافئین در موشهای دیابتیشده سبب افزایش هرچه بیشتر بیان پروتئین آپوپتوزی (Bax) و کاهش بیان پروتئین ضدآپوپتوزی (Bcl-2) در مقایسه با گروه کنترل سالم و دیابتی میشود؛ چنانچه افزایش در فعالیت ماشین آپوپتوزی به دنبال القای دیابت در بیشتر تحقیقات قبلی نیز به خوبی ثابت شده است. به طور مثال، گروه تحقیقاتی فانو-یووانگ و همکاران گزارش کردند که به دنبال تجویز رژیم غذایی با چربی بالا شامل 2 درصد کلسترول، 10 درصد چربی خوک و 88 درصد غذای معمولی به مدت 8 هفته و سپس تزریق درون صفاقی 25 میلیگرم در کیلوگرم استرپتوزوسین در موشهای نژاد اسپرادوگاولی، کاهش در عملکرد عضله قلبی همراه با کاهش در بیان پروتئین Bcl-2 و افزایش در بیان Bax و کاسپاز-3 مشاهده میشود [
11]. همچنین گروه مطالعاتی لیو و همکاران نیز معتقد بودند که تزریق STZ (55 میلیگرم در وزن بدن) در بافت میوکارد موشها باعث کاهش معنیدار بیان پروتئینهای ضدآپوپتوزی Bcl-2 و Bcl-xl و افزایش بیان پروتئینهای پیشآپوپتوزی Bax و Bad میشود [
7]. خانواده پروتئینهای Bcl-2 توسط حضور دُمینهای هومولوگ (BH) به دو دسته تقسیم میشوند: خانواده پروتئین های Bcl-2 براساس نواحی حفاظت شده و عملکردشان به سه گروه دسته بندی می شوند: 1-ضدآپوپنوزی چند ناحیه ای، 2-پیش آپوپتوزی چند ناحیه ای و تک ناحیه ای BH3. بهخوبی اثبات شده است که در سلولهای سالم، پروتئین ضدآپوپتوزی Bcl-2 یا Bcl-xl به پروتئینهای BH3 و Bax در غشای خارجی میتوکندری متصل شده و مانع از اُلیگومریزاسیون Bax و Bak برای تشکیل کانال الیگومری میشود. اتصال مستقیم پروتئینهای BH خاص نظیر Bim و PUMA به Bax باعث میشود آنها در غشای خارجی میتوکندری کانال الیگومری تشکیل بدهند. این عمل موجب ورود سیتوکروم-c به سیتوزول میشود تا در آنجا به پروتئین سازشدهنده (Apaf-1) متصل شده و سبب فعالسازی کاسپاز-9 و کاسپاز-3 و آغاز آبشار آپوپتوزی و مرگ سلولی شود. از طرفی، پروتئینهایی نظیر Bad به Bcl-2 متصل شده و با مهار توانایی آن برای اتصال به Bax سبب تشکیل کانال در غشای خارجی میتوکندری میشوند. این در حالی است که محرکهای متعددی مسیر آپوپتوزی را شروع یا مهار میکنند [
8،
9،
12]، به طوری که در پژوهش پیش رو چنین مشاهده شد که تجویز دو ماه مکمل کافئین منجر به افزایش وقایع آپوپتوزی از طریق تشدید بیان پروتئین پیشآپوپتوزی Bax و کاهش بیان پروتئین ضدآپوپتوزی Bcl-2 میشود. همسو با نتایج مطالعه حاضر، لیو و همکاران چنین اشاره کردند که کافئین سبب سرکوب تکثیر سلولی و القای آپوپتوز از طریق کاهش در بیان Bcl-2 و افزایش در بیان Bax در سلولهای معده انسانی میشود [
7]. به علاوه، وو و همکاران با بررسی کافِستول به عنوان یک مولکول دِترپن یافتشده در دانههای قهوه کافیا عربیکا، به افزایش در بیان پروتئین Bim و کاهش در بیان MCL-1 اذعان کردند [
13]. وانگ و همکاران نیز چنین نتیجهگیری کردند که حضور کافئین موجب افزایش آپوپتوز ناشی از سیسپلاتین (داروی ضدسرطان) در هر دو سلول سرطانی از طریق افزایش در پروتئینهای پیشآپوپتوتیکی همچون PUMA میشود [
18،
19]. به طوری که نشان داده شده است تجویز کافئین باعث سرکوب فعالیت مسیر پیامرسانی PI3-K/Akt و درنتیجه موجب دِفسفوریلاسیون و رهاسازی پروتئین Bad در سیتوزول شده که به نوبه خود با اتصال به Bcl-2 موجب تشکیل کانال و شروع وقایع آپوپتوزی میشود [
19]. پین ـ ژن و همکاران با انکوباسیون 24 ساعته سلولهای اُستئوبلاست انسانی تحت تیمار با کافئین (2 میلیمول) به افزایش نسبت پروتئین Bax/Bcl-2 و کاهش در پتانسیل غشای میتوکندری (MMP) و مدولاسیون نفوذپذیری میتوکندری متعاقب آزادسازی سیتوکروم-C در یک روش وابسته به مقادیر اشاره داشتند [
3]. این در حالی است که در تحقیق حاضر نیز نسبت پروتئین Bax/Bcl-2 به میزان 7 برابر در مقایسه با گروه کنترل سالم و 132 درصد نسبت به گروه کنترل دیابتی افزایش معنیدار داشت. محققان سازوکار مولکولی که کافئین از طریق آن موجب تحریک پیامرسانی مسیرهای آپوپتوزی میشود را شامل غیرفعالسازی مسیرهای پیامرسانی بقای سلولی PI3K-Akt-mTOR و فعالسازی مسیرهای دخیل در مرگ سلولی همچون پروتئینکیناز 2 فعالشده بر اثر P21 یا PAK2 و کینازهای N-ترمینال و C-جانوس (JNK) میدانند [
5،
6].
ژیوی هی و همکاران متعاقب تیمار 24 ساعته با مقادیر پائین کافئین (450-50 میکرومول) به القای آپوپتوزیس در سلولهای JB6 از طریق افزایش فسفوریلاسیون باقیمانده Ser15 پروتئین p53 و بیان پروتئین Bax و کاسپاز-3 اشاره داشتند [
20]. فسفوریلاسیون پروتئین P53 در باقیمانده Ser15 یک گام ضروری برای فعالسازی وابسته به P53 است. P53 پروتئین بالادستی Bax بوده و خود Bax نیز از افکتورهای پائیندستی P53 است. Bax توانایی آزادسازی سیتوزولی سیتوکروم-C را دارد، در صورتی که به نوبه خود باعث فعالسازی کاسپاز-3 به عنوان یکی از اعضای کلیدی در شروع فرایند آپوپتوزیس میشود. کاسپاز-3 فعالشده شکسته شده و شاخصی است که موجب کلیواژ DNA میشود [
18،
20].
اخیراً رحیمی و همکاران در مخالفت با نتایج پژوهش حاضر، اظهار داشتند که مصرف حاد 6 میلیگرم در کیلوگرم وزن بدن قبل از انجام تمرینات مقاومتی (با شدت 85 درصد یک تکرار بیشینه) در ورزشکاران مرد تمرینکرده موجب کاهش معنیدار سطوح خونی Bax و نسبت Bax/Bcl-2 در مقایسه با گروه دارونما شد، در حالی که میزان Bcl-2 به طور قابل توجهی در هر دو گروه کافئین و دارونما افزایش پیدا کرده بود [
21]. تعدادی از مطالعات فیزیولوژیکی چنین اظهار میکنند که تجویز کافئین در یک روش وابسته به دُز باعث بروز آپوپتوز از طریق بیشبیانی پروتئین Bax در سلولها میشود [
15]. چنانچه کافئین در یک دُز پایین باعث ممانعت از آپوپتوز شده، در حالی که در مقادیر متوسط به بالا باعث تحریک فرایند مرگ سلولی آپوپتوتیک میشود [
15]. به طوری که یکی از محدودیتهای تحقیق حاضر عدم اندازهگیری پاسخ دُزهای متفاوتی از کافئین در بافت دیابتیشده بود [
22].
یافتههای ما نیز در تحقیق حاضر نشان داد تجویز یک دُز متوسط به بالا در حیوانات دیابتیشده نهتنها سبب سرکوب آپوپتوز ناشی از دیابت نشد، بلکه باعث تشدید بیان شاخصهای آپوپتوزی نیز شد. در این راستا، جعفری و همکاران [
15] و سینها و همکاران [
23] اظهار داشتند که کافئین در مقادیر برابر و بالاتر از 50 میکرومول در لیتر به ترتیب باعث القای مسیرهای مرگ سلولی آپوپتوتیک و اتوفاژیک میشود. این مقادیر بسیار شبیه به دُزهایی است که پس از مصرف 4 تا 5 فنجان قهوه یا مصرف خالص کافئینی برابر با 5 تا 6 میلیگرم به ازای هر کیلوگرم از وزن بدن در مدل انسانی یا بیش از 70 میلیگرم در کیلوگرم از وزن بدن در مدل حیوانی همچون تحقیق حاضر وارد بدن میشود [
16،
23].
از طرفی چنانچه پیشتر نیز ذکر شد، اثرات آپوپتوزی کافئین احتمالاً به وضعیت سلولی نیز بستگی دارد. چنانکه در مطالعات فوقالذکر، اکثراً اثرات کافئین بر سلولهای تحت سرطان یا گلیوما مورد بررسی و مطالعه قرار گرفته که کافئین به طور مثبتی همچون یک عامل ضدسرطانی سبب تسریع در مرگ سلولی در این بدخیمیها شده است (در پژوهش حاضر نیز بافت مورد بررسی در یک وضعیت میوپاتی قرار داشت) [
3،
20،
23].
نتیجهگیری
مطالعه حاضر نشان داد القای دیابت موجب افزایش میزان فعالیت ماشین آپوپتوتیک از طریق افزایش بیان پروتئین Bax به عنوان یکی از شاخصهای پیشآپوپتوزی و کاهش بیان پروتئین ضدآپوپتوزی Bcl-2 شد. در حالی که تجویز کافئین نتوانست موجب برقراری تعادل در فرایند افزایشیافته مرگ سلولی آپوپتوزی شد. با وجود این، نشان داده شد تجویز بلندمدت کافئین در تعامل با بیماری دیابت نوع 2 باعث تشدید پیامرسانی و وقوع مرگ سلولی برنامهریزیشده میشود. هرچند اصلیترین محدودیت مطالعه حاضر عدم تیمار آزمودنیها با دُزهای متفاوت کافئینی و همچنین بررسی گروههای مطالعاتی متنوعتر با سایر مکملهای دخیل در درمان بیماری دیابت و مقایسه آنها با کافئین است که نیاز به بررسیهای بیشتری در این زمینه است.
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
تحقیق حاضر تحت نظارت کمیته اخلاق دانشگاه علومپزشکی تبریز با کد اخلاق IR.TBZMED.VCR.REC.1397.389 انجام شد.
حامی مالی
مقاله حاضر قسمتی از رساله دکتری تخصصی نویسنده اول مقاله در گرایش بیوشیمی و متابولیسم ورزشی، گروه فیزیولوژی ورزشی، دانشکده تربیتبدنی و علوم ورزشی دانشگاه تبریز است و بخشی از هزینه طرح حاضر توسط معاونت پژوهشی و تحصیلات تکمیلی دانشگاه تبریز تأمین شده است.
مشارکت نویسندگان
مجری طرح: علی ضرغامی خامنه؛ نگارش و ویرایش مقاله: افشار جعفری؛ تجزیه و تحلیل دادههای آماری: سعید نیکوخصلت؛ کارهای مربوط به آزمایشگاه: پوران کریمی.
تعارض منافع
نویسندگان تصریح میکنند که هیچگونه تضاد منافعی در این مقاله وجود ندارد.
تشکر و قدردانی
بدینوسیله نویسندگان از زحمات کلیه همکاران و همچنین مدیریت آزمایشگاه حیوانی مرکز تحقیقات علوم اعصاب دانشگاه علومپزشکی تبریز و همچنین شرکت سامانه یاختهپژوهان سارا کمال تشکر و امتنان را دارند.
References
1.
Preedy VR. Caffeine: Chemistry, analysis, function and effects. London: Royal Society of Chemistry; 2015. https://books.google.com/books/about/Caffeine.html?id=1GsoDwAAQBAJ
2.
Monteiro J, Alves MG, Oliveira PF, Silva BM. Pharmacological potential of methylxanthines: Retrospective analysis and future expectations. Critical Reviews in Food Science and Nutrition. 2019; 59(16):2597-2625. [DOI:10.1080/10408398.2018.1461607] [PMID]
3.
Lu PZ, Lai CY, Chan WH. Caffeine induces cell death via activation of apoptotic signal and inactivation of survival signal in human osteoblasts. International Journal of Molecular Sciences. 2008; 9(5):698-718. [DOI:10.3390/ijms9050698] [PMID] [PMCID]
4.
Bode AM, Dong Z. The enigmatic effects of caffeine in cell cycle and cancer. Cancer Letters. 2007; 247(1):26-39. [DOI:10.1016/j.canlet.2006.03.032] [PMID] [PMCID]
5.
Nakaso K, Ito S, Nakashima K. Caffeine activates the PI3K/Akt pathway and prevents apoptotic cell death in a Parkinson’s disease model of SH-SY5Y cells. Neuroscience Letters. 2008; 432(2):146-50. [DOI:10.1016/j.neulet.2007.12.034] [PMID]
6.
Wang L, Lu L. Pathway-specific effect of caffeine on protection against UV irradiation-induced apoptosis in corneal epithelial cells. Investigative Ophthalmology & Visual Science. 2007; 48(2):652-60. [DOI:10.1167/iovs.06-1007] [PMID] [PMCID]
7.
Liu H, Zhou Y, Tang. Caffeine induces sustained apoptosis of human gastric cancer cells by activating the caspase-9/caspase-3 signalling pathway. Molecular Medicine Reports. 2017; 16(3):2445-54. [DOI:10.3892/mmr.2017.6894] [PMID] [PMCID]
8.
Diamantis A, Magiorkinis E, Sakorafas GH, Androutsos G. A brief history of apoptosis: From ancient to modern times. Onkologie. 2008; 31(12):702-6. [DOI:10.1159/000165071] [PMID]
9.
Favaloro B, Allocati N, Graziano V, Di Ilio C, De Laurenzi V. Role of apoptosis in disease. Aging (Albany NY). 2012; 4(5):330-49. [DOI:10.18632/aging.100459] [PMID] [PMCID]
10.
Harvey PA, Leinwand LA. The cell biology of disease: Cellular mechanisms of cardiomyopathy. Journal of Cell Biology. 2011; 194(3):355-65. [DOI:10.1083/jcb.201101100] [PMID] [PMCID]
11.
Xiong FY, Tang ST, Su H, Tang HQ, Jiang P, Zhou Q, et al. Melatonin ameliorates myocardial apoptosis by suppressing endoplasmic reticulum stress in rats with long term diabetic cardiomyopathy. Molecular Medicine Reports. 2018; 17(1):374-81. [DOI:10.3892/mmr.2017.7841] [PMID]
12.
Corsetti G, Pasini E, Assanelli D, Bianchi R. Effects of acute caffeine administration on NOS and Bax/Bcl2 expression in the myocardium of rat. Pharmacological Research. 2008; 57(1):19-25. [DOI:10.1016/j.phrs.2007.07.007] [PMID]
13.
Woo SM, Min KJ, Seo BR, Nam JO, Choi KS, Yoo YH, et al. Cafestol overcomes ABT-737 resistance in Mcl-1-overexpressed renal carcinoma Caki cells through downregulation of Mcl-1 expression and upregulation of Bim expression. Cell Death & Disease. 2014; 5(11):e1514. [DOI:10.1038/cddis.2014.472] [PMID] [PMCID]
14.
Sasidharan SR, Joseph JA, Anandakumar S, Venkatesan V, Ariyattu Madhavan CN, Agarwal A. An experimental approach for selecting appropriate rodent diets for research studies on metabolic disorders. BioMed Research International. 2013; 2013:752870. [DOI:10.1155/2013/752870] [PMID] [PMCID]
15.
Jafari M, Rabbani A. Studies on the mechanism of caffeine action in alveolar macrophages: Caffeine elevates cyclic adenosine monophosphate level and prostaglandin synthesis. Metabolism. 2004; 53(6):687-92. [DOI:10.1016/j.metabol.2003.08.004] [PMID]
16.
Saiki S, Sasazawa Y, Imamichi Y, Kawajiri S, Fujimaki T, Tanida I, et al. Caffeine induces apoptosis by enhancement of autophagy via PI3K/Akt/mTOR/p70S6K inhibition. Autophagy. 2011; 7(2):176-87. [DOI:10.4161/auto.7.2.14074] [PMID] [PMCID]
17.
Farhadi H, Siahkohian M, Lotfali B, Pouran K. [Effects of aerobic training and hypoxia on expression angiogenic factors in cardiac male Wistar rats (Persian)]. Journal of Sport in Biomotor Sciences. 2016; 2(16):70-9. http://journals.hsu.ac.ir/sbs/article-1-708-en.html
18.
Huang PC, Wang GJ, Fan MJ, Asokan Shibu M, Liu YT, Padma Viswanadha V, et al. Cellular apoptosis and cardiac dysfunction in STZ-induced diabetic rats attenuated by anthocyanins via activation of IGFI-R/PI3K/Akt survival signaling. Environmental Toxicology. 2017; 32(12):2471-80. [DOI:10.1002/tox.22460] [PMID]
19.
Wang G, Bhoopalan V, Wang D, Wang L, Xu X. The effect of caffeine on cisplatin-induced apoptosis of lung cancer cells. Experimental Hematology & Oncology. 2015; 4:5. [DOI:10.1186/2162-3619-4-5] [PMID] [PMCID]
20.
He Z, Ma W-Y, Hashimoto T, Bode AM, Yang CS, Dong Z. Induction of apoptosis by caffeine is mediated by the p53, Bax, and caspase 3 pathways. Cancer Research. 2003; 63(15):4396-401. [PMID]
21.
Rahimi MR, Khabiri P, Faraji H. Effects of caffeine ingestion on resistance exercise-induced apoptosis in athletes: A randomized, double-blind, placebo-controlled, crossover study. Progress in Nutrition. 2018; 20(4):563-9. [Doi:10.23751/pn.v20i4.6442]
22.
Zarghami-Khameneh A, Jafari A. [The effect of different doses of caffeine and a single bout of resistant-exhaustive exercise on muscle damage indices in male volleyball players (Persian)]. Feyz. 2014; 18(3):220-8. http://feyz.kaums.ac.ir/article-1-2304-en.html
23.
Sinha RA, Farah BL, Singh BK, Siddique MM, Li Y, Wu Y, et al. Caffeine stimulates hepatic lipid metabolism by the autophagy-lysosomal pathway in mice. Hepatology. 2014; 59(4):1366-80. [DOI:10.1002/hep.26667] [PMID]


 ، افشار جعفری*2
، افشار جعفری*2 

 ، سعید نیکوخصلت1
، سعید نیکوخصلت1 

 ، پوران کریمی3
، پوران کریمی3 


.jpg)
