

Javadikia M, Barjaste yazdi A, Khajei R, Hosein abadi M R. The Effect of 8 Weeks High-Intensity Interval Training and Portulaca Oleracea Supplement on Serum Level of TAC, MDA, CRP, TNF-α in Rats with Non-Alcoholic Fatty Liver Disease. cmja 2023; 12 (4) :13-21
URL:
http://cmja.arakmu.ac.ir/article-1-912-fa.html
جوادی کیا مهدی، برجسته یزدی آمنه، خواجه ای رامبد، حسین آبادی محمدرضا. تأثیر 8 هفته تمرین تناوبی شدید و مصرف مکمل خرفه بر سطوح سرمی مالون دی آلدئید (MDA)، ظرفیت آنتی اکسیدانی تام (TAC)، پروتئین واکنشگر c (CRP) و عامل نکروز تومور α (TNF-α) در رتهای نر مبتلا به کبد چرب غیرالکلی. فصلنامه طب مکمل. 1401; 12 (4) :13-21
URL: http://cmja.arakmu.ac.ir/article-1-912-fa.html
1- گروه تربیت بدنی، واحد نیشابور، دانشگاه آزاد اسلامی، نیشابور، ایران
2- گروه تربیت بدنی، واحد نیشابور، دانشگاه آزاد اسلامی، نیشابور، ایران ، barjaste.a7@gmail.com
متن کامل [PDF 707 kb]
(941 دریافت)
|
چکیده (HTML) (1715 مشاهده)
متن کامل: (595 مشاهده)
مقدمه
بیماری کبد چرب غیر الکلی (NAFLD) طیفی از اختلالات کبدی است که با وجود استئاتوز در بیش از 5 درصد از سلولهای کبدی تعریف میشود (1). NAFLD از کبد چرب غیر الکلی (NAFL) خفیف و استئاتوهپاتیت غیر الکلی شدیدتر (NASH) تشکیل شده است. NASH شکل پیشرونده NAFLD است و با استئاتوز، بالون شدن سلولهای کبدی، التهاب لوبولار و تقریباً همیشه فیبروز مشخص میشود (2). سیروز یک نارسایی اندام در مرحله نهایی است که نیاز به پیوند کبد دارد یا ممکن است منجر به سرطان کبد شود (3).
مکانیسمهای ایجاد کننده NAFLD تا به امروز نامشخص است. بر اساس نظریهای موسوم به نظریه دو ضربه، تبدیل و پیشرفت استئاتوز ساده به استئاتوهپاتیت و فیبروز پیشرفته نتیجه دو ضربه میباشد (4). که ضربه اول در اثر تجمع چربی در کبد باعث ایجاد التهاب و مقاومت به انسولین زده میشود و ضربه دوم در اثر ایجاد استرس اکسایشی در نتیجه تجمع چربی در کبد است که باعث تسریع در ایجاد التهاب، پیشرفت استئاتوز و فیبروز میگردد (5) که میتواند در نهایت منجر به سیروز کبدی و مرگ بیمار گردد. در این راستا چربی اضافی در کبد باعث سمیت چربی میشود و منجر به نارسایی اندامکها عمدتاً اختلال در عملکرد میتوکندری و استرس شبکه آندوپلاسمی میشود (6, 7). یک میتوکندری ناکارآمد ظرفیت بالایی برای اکسید کردن اسیدهای چرب دارد که منجر به تولید گونههای فعال اکسیژن و ایجاد استرس اکسایشی به دلیل عدم تعادل بین تولید گونههای فعال اکسیژن و آنتی اکسیدانها میشود (8). گونههای فعال اکسیژن با اثرات سمی خود منجر به پراکسیداسیون لیپیدهای غشایی و تولید مالون دی آلدئید (MDA)، و 4-هیدروکسی نان انال (4-HNE)، میگردند و میتوانند با فعال سازی سلولهای ستارهای شکل در کبد که کلاژن سنتز میکنند، سبب ایجاد فیبروز کبدی شوند (9). همانطور که عنوان شد آنتی اکسیدان ها با مقابله و حذف عوامل پراکسیدانی با استرس اکسایشی ناشی از آنها مقابله میکنند. در شرایط NAFLD، سیستم دفاع آنتی اکسیدانی بدن (شامل تمامی آنتی اکسیدان ها میباشد که با عنوان ظرفیت آنتی اکسیدانی تام (TAC) شناخته میشود، از سلولها در برابر این استرس اکسایشی محافظت میکند)، نیز دستخوش تغییر میگردد (5). پژوهشهای مختلفی افزایش پراکسیداسیون لیپیدی و کاهش دفاع آنتی اکسیدانی تام در بیماران و نمونههای NAFLD را به خوبی ثابت کردهاند (10, 11).
از طرف دیگر در طی NAFLD، سیگنالدهی فاکتور رونویسی فاکتور هستهای–کاپا β (NF-κβ) از طریق مهار عامل بالادستی مهارکننده فاکتور هستهای NF-κβ (IKKβ) افزایش مییابد. فعال شدن NF-κβ باعث تولید واسطههای التهابی مانند فاکتور نکروز تومور α (TNF-α)، اینترلوکین-6 (IL-6) و IL-1β میشود. این سایتوکاین ها سلولهای کوپفر که ماکروفاژهای کبدی میباشند را برای میانجیگری التهاب در NAFLD فعال میکنند (12, 13). همچنین التهاب سیستمیک درجه پایین با افزایش سطوح نشانگرهای التهابی مختلف از جمله پروتئین واکنشگر c (CRP)، همراه است (14). افزایش سطح CRP در بیماران مبتلا به NAFLD به عنوان یک بیماری که با افزایش التهاب سیستمیک همراه است، به خوبی مورد اثبات قرار گرفته است (15). حتی لی و همکاران (2017) افزایش سطح CRP را به عنوان پیشگویی کننده شروع NAFLD در بیماران سالم معرفی کردهاند (16).
هرچند در حال حاضر هیچ اتفاق نظری در درمان برای NAFLD وجود ندارد ولی تغییرات در سبک زندگی مؤثر همچون تمرینات ورزشی و کنترل تغذیهای و کاهش وزن برای کنترل این بیماری مورد تاکید قرار گرفته است (17). در این ارتباط در مطالعهای که توسط سانگ و همکاران روی ۱۶۹۳۴۷ مرد و زن توسط سونوگرافی به مدت ۵ سال انجام شد، اولین دادههای اپیدمیولوژیک طولی را ارائه کرد که از نقش ورزش در پیشگیری و درمان NAFLD حمایت میکرد. آنها نشان دادند که هر سطح ورزش متوسط تا شدید با کاهش خطر ابتلا به NAFLD جدید و رفع NAFLD که از قبل موجود باشد، همراه بود (18). تمرینات اینتروال با شدت بالا (HIIT)، نوعی خاص از تمرینات ورزشی پرشدت هستند، که شامل دورههای کوتاه و متناوب فعالیت شدید و به دنبال آن دورههای استراحت مکرر یا ورزش با شدت پایین است (19, 20). مطابق با مطالعات فرانسیس و لیتل، شدت تمرینات ورزشی در بهبود اختلال متابولیک مؤثر است (21). به نظر میرسد که هر دو تمرین هوازی و بی هوازی برای حداقل 4 ماه به میزان یکسانی باعث کاهش کل بافت چربی، چربی کبد و BMI در NAFLD میشوند، در حالی که هیچ اطلاعاتی در مورد اثرات بالقوه متفاوت آنها بر بافت شناسی کبد وجود ندارد (22). از سوی دیگر، بافت شناسی کبد به شدت ورزش بستگی دارد و بر اساس برخی دادهها، با فعالیت با شدت بالا بیشتر بهبود مییابد (22, 23).
خرفه گیاهی یک ساله است که به طور گسترده در مناطق نیمه گرمسیری و گرمسیری توزیع میشود. همچنین یک سبزی خوراکی است که اغلب در پختن سوپ و سالاد در رژیم غذایی مدیترانهای استفاده میشود که برای کاهش NAFLD مفید است (24). به طور سنتی برای درمان هیپرلیپیدمی، هیپرگلیسمی، چاقی و سایر اختلالات متابولیک استفاده میشود (25, 26). دانههای خرفه اثرات مفیدی بر تنظیم گلوکز و لیپیدهای سرم و افزایش حساسیت به انسولین در بیماران مبتلا به NAFLD دارند (27). همچنین عنوان شده است که این گیاه دارویی یک اثر حفاظتی بر روی کبد داشته و این عضو را در برابر آسیبهای ناشی از هجوم رادیکالهای آزاد و پراکسیداسیون لیپیدی محافظت میکند (28). و به عنوان یک استعداد بالقوهای در مورد درمان NAFLD معرفی شده است (29). در این ارتباط علی نیا و همکاران بیان کردند که مصرف مکمل خرفه همراه با تمرینات ترکیبی میتواند در کاهش غلظت پلاسمایی چربیهای خون و بهبود سونوگرافی کبد در زنان چاق مبتلا به کبد چرب غیرالکلی مؤثر باشد (30).
در مجموع از آنجا که بیماری زایی NAFLD به تعادل بین عوامل پرواکسیدان و آنتی اکسیدانی و همپنین عوامل التهابی مربوط است، ما فرض کردیم که تمرین تناوبی شدید در هم افزایی با مکمل گیاهی خرفه ممکن است یک استراتژی جدید درمانی برای بیماران مبتلا به NAFLD به همراه داشته باشد. لذا در این تحقیق پژوهشگران به دنبال پاسخ به این سؤال هستند که آیا تمرینات تناوبی با شدت بالا و مصرف همزمان مکمل خرفه میتواند بر سطوح MDA، TAC، CRP و TNF-α رت های نر مبتلا شده به NAFLD با رژیم غذایی پرچرب، تأثیر گذار باشد؟
روش کار
پژوهش حاضر از نوع تجربی با طرح پس آزمون به همراه دو گروه کنترل و سه گروه تجربی بود که به شیوه آزمایشگاهی انجام شد. در این تحقیق از 25 سر رت نر بالغ نژاد ویستار با دامنه وزنی 160 تا 185 گرم و سن شش هفته استفاده شد؛ که از آزمایشگاه حیوانات دانشگاه علوم پزشکی خراسان شمالی خریداری گردید. مطابق با خطمشی انجمن ایرانیان حمایت از حیوانات آزمایشگاهی در قفسهای 3 یا 4 تایی و تحت شرایط استاندارد (چرخه 12 ساعته روشنایی- تاریکی، دمای 3±22 درجه سانتیگراد) با دسترسی آزاد به آب و غذا نگهداری شدند. پس از یک هفته آشنایی و سازگاری با محیط جدید، 5 سر رت به عنوان گروه رژیم غذایی استاندارد (گروه اول) برای بررسی تغییرات وزن در طول دوره پژوهش انتخاب شدند 20 سر رت دیگر، به مدت 12 هفته تحت رژیم غذایی پرچرب قرار گرفتند تا مبتلا به NAFLD شوند. این رژیم غذایی شامل 60 درصد چربی، 20 درصد کربوهیدرات و 20 درصد پروتئین بود (31). پس از 12 هفته، موشهای صحرایی نر بالغ بهطور تصادفی به چهار گروه کنترل کبد چرب، تمرین، تمرین + مکمل و مکمل با تعداد برابر در هر گروه (5 سر) تقسیم شدند. با مصرف رژیم غذایی پرچرب (60 درصد چربی) به مدت 12 هفته مبتلا شدن به کبد چرب غیر الکلی صورت گرفت. لازم به ذکر است، چون هدف این پژوهش بررسی اثر مستقل تمرین ورزشی و مکمل گیاهی دانه خرفه بود؛ گروه کنترل بیمار و 3 گروه آزمایشی تا انتهای پژوهش، با رژیم غذایی پرچرب، تغذیه شدند.
جهت تهیه عصاره گیاه خرفه از بخشهای هوایی گیاه خرفه در منطقه رویش آن در شهرستان چناران خراسان رضوی جمع آوری و پس از شناسایی توسط کارشناس گیاه شناسی با آب شستشو و بعد از خشک شدن آسیاب شده و بعد از تأیید در آزمایشگاه کنترل کیفی بر اساس وزن موش با دوز 400 mg/kg به گروههای مربوطه به صورت گاواژ خورانده شد (32).
پروتکل تمرین تناوبی شدید: با شدت 75 درصد سرعت بیشینه که معادل 7 تلاش 1 دقیقهای و سرعت 30 متر در دقیقه و استراحت فعال بین فعالیتها با شدت 15 درصد سرعت بیشینه درهفتهٔ اول انجام شد که تدریجاً با افزایش متوسط ۸۰ درصد سرعت بیشینه و در هفته دوم ۸۵ درصد سرعت بیشینه و در هفته سوم ۹۰ درصد سرعت بیشینه و در هفته چهارم ادامه و تا پایان هفته هشتم انجام شد. تناوبهای استراحت فعال شامل 2 دقیقه دویدن با شدت ۳۰ درصد سرعت بیشینه از هفته اول تا سوم و ۲۰ درصد در ابتدای هفته چهارم تا پایان دوره تمرین بود. شروع تمرین با گرم کردن به مدت 3 دقیقه با شدت 10 متر در دقیقه و 2 دقیقه با شدت 15 متر و سرد کردن به مدت 1 دقیقه با شدت 15 متر در دقیقه، 2 دقیقه با شدت 10 متر در دقیقه به پایان رسید. رتها درگروه تمرین، 5 روز در هفته با دو روز استراحت در وسط و آخر هفته به مدت 8 هفته تمرین کردند (33). در جدول 1 پروتکل تمرین تناوبی شدید با جزئیات ارائه شده است.
جدول 1. جزئیات پروتکل تمرین تناوبی شدید
| هفته تمرین |
تناوب شدید |
استراحت بین ستها |
|
تعداد ست (یک دقیقه) |
سرعت (متربردقیقه) |
تعداد ست (یک دقیقه) |
سرعت (متر بر دقیقه) |
| اول |
7 |
30 |
6 |
15 |
| دوم |
8 |
30 |
7 |
15 |
| سوم |
8 |
34 |
7 |
17 |
| چهارم |
9 |
38 |
8 |
19 |
| پنجم |
9 |
42 |
8 |
21 |
| ششم |
9 |
46 |
8 |
23 |
| هفتم |
9 |
50 |
8 |
23 |
| هشتم |
9 |
54 |
8 |
25 |
تمامی رت ها 48 ساعت پس از آخرین جلسه تمرین، با تزریق درون صفاقی ترکیبی از کتامین (60 میلیگرم به ازای هر کیلوگرم) و زایلازین (5 میلیگرم به ازای هر کیلوگرم) با نسبت 5 به 2 بیهوش شدند. سپس توسط متخصصین کارآزموده جراحی انجام و خون گیری از بطن چپ رت ها انجام شد. نمونه خون به آرامی در جدار داخلی لوله آزمایش حاوی هپارین تخلیه شد. سپس لولههای آزمایش در چاهکهای دستگاه سانتریفیوز قرار داده شد و دستگاه روی سرعت 3000 دور در دقیقه به مدت 10 دقیقه جهت جداسازی سرم تنظیم شد. پس از سانتریفیوژ، سرم توسط سمپلر به میکروتیوپ 2 منتقل و در فریزر 70- درجه سانتی گراد نگه داری شد.
سطح MDA به روش رنگ سنجی با استفاده از کیت تحقیقاتی شرکت زل بایو و طبق دستورالعمل شرکت سازنده اندازه گیری شد. حساسیت روش مذکور 1/0 میکرومول بود. سطح TAC نیز با استفاده از روش رنگ سنجی با استفاده از کیت نحقیقاتی شرکت رندوکس و طبق دستورالعمل شرکت سازنده اندازه گیری شد. حساسیت روش مذکور 1/0 میکرومول بود. برای اندازه گیری سطح CRP سرم با استفاده از کیت الایزا به شماره کاتالوگ DY1744 از شرکت دئوست استفاده گردید. سطح TNF-α سرم نیز با استفاده از کیت الایزا و با استفاده از کیت شماره DY510 از شرکت دئوست استفاده گردید.
به منظور بررسی نرمال بودن دادهها از آزمون شاپیروویلک استفاده شد. پس از مشخص شدن طبیعی بودن توزیع دادهها، به منظور تجزیه و تحلیل آماری دادهها و مقایسه بین گروهها از آزمون آنالیز واریانس یک طرفه و جهت مقایسه جفتی گروهها از آزمون تعقیبی توکی در سطح معناداری 05/0 P< استفاده شد. تمام محاسبات آماری با استفاده از نرم افزار آماری SPSS20 صورت گرفت.
یافتهها
در این بخش اطلاعات توصیفی مربوط به وزن موشها در ابتدا، پس از 12 هفته رژیم غذایی پرچرب و انتهای دوره پژوهش ارائه شده است. جهت اطمینان از همگن بودن گروهها از نظر وزن در پیش آزمون از آزمون آنالیز واریانس یک طرفه استفاده شد که نتایج آن در یک ستون در جدول 2 قرار داده شده است.
با توجه به جدول 2 و سطح معناداری گزارش شده میتوان دریافت گروهها در گروه بندی اولیه تفاوت معناداری با یکدیگر ندارند (889/0=P). پس از 12 هفته دریافت رژیم غذایی پرچرب جهت القای NAFLD در موشهای صحرایی باعث افزایش وزن موشها گردیده است (008/0=P). بعد از 8 هفته تمرین تناوبی شدید و دریافت مکمل خرفه نیز تفاوت معناداری بین گروههای تحقیق مشاهده شد (02/0=P).
به منظور مقایسه سطوح سرمی MDA و TAC در گروههای تحقیق از آزمون آنالیز واریانس یک طرفه و آزمون تعقیبی توکی استفاده شد. در جدول 3 یافتههای آزمون آماری در خصوص مقایسه اثر تمرین تناوبی شدید همراه با مصرف مکمل خرفه بر سطوح سرمی MDA و TAC موشهای صحرایی نر مبتلا به NAFLD در گروههای تحقیق ارائه شده است.
سطوح سرمی MDA گروههای تحقیق. نتایج حاصل از آنالیز واریانس یک طرفه نشان داد که بین سطح سرمی MDA گروههای تحقیق پس از 8 هفته تمرین تمرین تناوبی شدید و مصرف مکمل خرفه، تفاوت معنی داری وجود دارد (90/3=F و 017/0=P). نتایج آزمون تعقیبی توکی نشان داد که سطح سرمی MDA در گروه کنترل کبد چرب به طور معنی داری نسبت به سالم کنترل بالاتر بود (034/0=P). سطح این شاخص در گروه مکمل و تمرین همراه با مکمل به طور معنی داری نسبت به گروه کنترل کبدچرب پایینتر بود (مقادیر p به ترتیب 021/0 و 049/0). اما سطح سرمی MDA در گروه تمرین نسبت به کنترل کبد چرب، تفاوت معنی داری مشاهده نشد (08/0=P). نمودار 1 مقایسه سطح سرمی MDA گروههای تحقیق را متعاقب 8 هفته تمرین تمرین تناوبی شدید و مصرف مکمل خرفه ارائه میدهد.
جدول 2. مقایسه وزن (گرم) آزمودنیها در پیش آزمون و پس آزمون گروههای تحقیق (مقادیر بر اساس انحراف معیار±میانگین)
| گروهها |
مرحله |
| پیش آزمون |
هفته دوازدهم |
پس آزمون |
| کنترل سالم |
07/5±68/206 |
67/10±86/235 |
35/18±78/276 |
| کنترل کبد چرب |
23/6±50/207 |
29/16±42/265 |
85/21±48/309 |
| تمرین |
76/5±38/209 |
05/10±20/257 |
41/17±32/268 |
| مکمل |
64/6±58/209 |
18/15±40/266 |
22/14±16/284 |
| تمرین و مکمل |
29/4±54/208 |
93/13±36/259 |
24/12±48/277 |
| P |
889/0 |
008/0* |
02/0* |
* نشانه تفاوت معنی دار بین گروههای تحقیق در 05/0>P.
جدول 3. مقایسه سطوح شاخصهای تحقیق (میانگین±انحراف معیار) در گروههای تحقیق و یافتههای آزمون آنالیز واریانس
| شاخص |
کنترل سالم |
کنترل کبد چرب |
تمرین |
مکمل |
تمرین و مکمل |
F |
P |
| MDA(mmol/l) |
05/0±66/0 |
11/0±96/0 |
21/0±70/0 |
14/0±68/0 |
16/0±64/0 |
90/3 |
017/0* |
| TAC(mmol/l) |
33/0±76/1 |
15/0±50/1 |
13/0±84/1 |
23/0±28/2 |
38/0±24/2 |
623/7 |
001/۰* |
| CRP(mg/l) |
69/14±99/50 |
83/16±36/99 |
03/11±19/74 |
54/8±88/68 |
05/6±23/50 |
89/13 |
001/0* |
| TNF-α(pg/ml) |
18/9±52/30 |
21/15±46/60 |
73/7±86/39 |
77/5±64/36 |
97/5±42/29 |
265/9 |
001/۰* |
* نشانه تفاوت معنادار بین گروههای تحقیق در سطح 05/0>P.
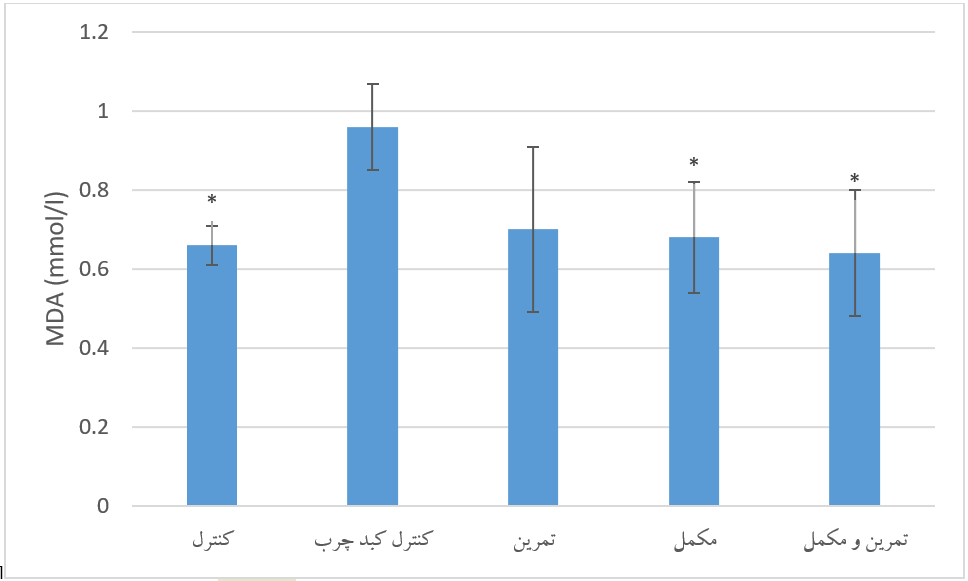
نمودار 1. مقایسه سطح سرمی MDA متعاقب 8 هفته تمرین تناوبی شدید و مصرف مکمل خرفه در گروههای تحقیق.* نشانه تفاوت معنادار نسبت به گروه کبد چرب کنترل درسطح معناداری 05/0P<.
سطوح سرمی TAC گروههای تحقیق. نتایج حاصل از آنالیز واریانس یک طرفه نشان داد که بین سطح سرمی TAC گروههای تحقیق پس از 8 هفته تمرین تناوبی شدید و مصرف مکمل خرفه، تفاوت معنی داری وجود دارد (623/7=F و 001/0=P). نتایج آزمون تعقیبی توکی نشان داد که سطح سرمی TAC در گروه مکمل نسبت به گروه کنترل و کنترل کبد چرب به طور معنی داری بالاتر بود (مقادیر p به ترتیب 044/0 و 001/0). سطح این شاخص در گروه تمرین همراه با مکمل نسبت به گروه کنترل کبد چرب به طور معناداری بالاتر بود (003/0=P). اما بین سطح سرمی TAC در گروه کنترل و کنترل کبد چرب و تمرین تفاوت معناداری مشاهده نشد (05/0P>). نمودار 2 مقایسه سطح سرمی TAC گروههای تحقیق را متعاقب 8 هفته تمرین تناوبی شدید و مصرف مکمل خرفه ارائه میدهد.
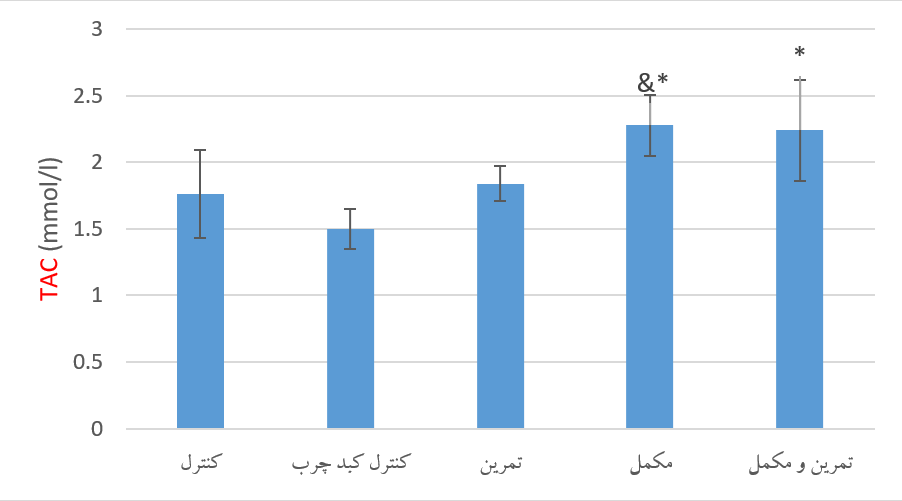
نمودار 2. مقایسه سطح سرمی TAC متعاقب 8 هفته تمرین تناوبی شدید و مصرف مکمل خرفه در گروههای تحقیق.* نشانه تفاوت معنادار نسبت به گروه کبد چرب کنترل و & نشانه تفاوت معنادار نسبت به گروه کنترل درسطح معناداری 05/0P<.
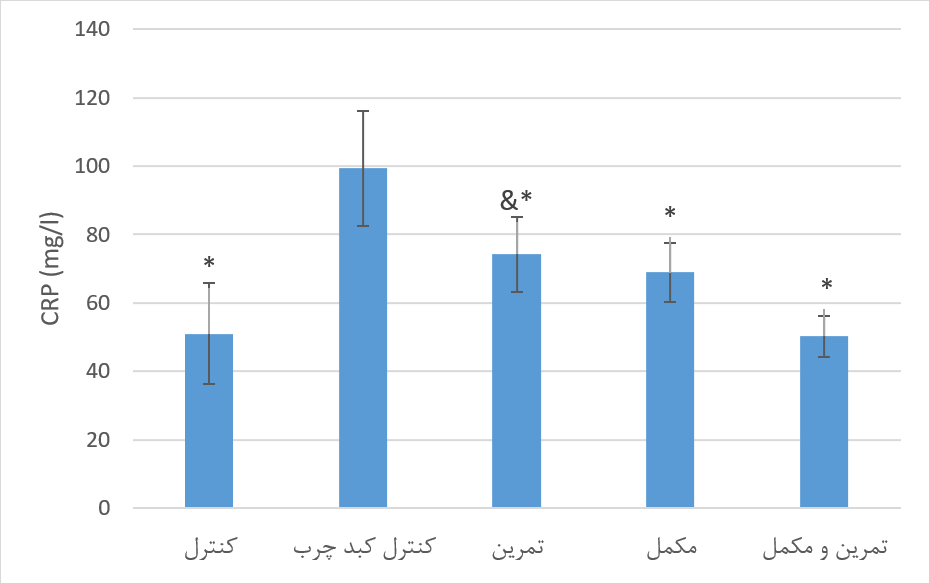
نمودار 3. مقایسه سطح سرمی CRP متعاقب 8 هفته تمرین تناوبی شدید و مصرف مکمل خرفه در گروههای تحقیق. * نشانه تفاوت معنادار نسبت به گروه کبد چرب کنترل و & نشانه تفاوت معنادار نسبت به گروه سالم کنترل در سطح معناداری 05/0P<.
سطوح سرمی CRP گروههای تحقیق. نتایج حاصل از آنالیز واریانس یک طرفه نشان داد که بین سطح سرمی CRP گروههای تحقیق پس از 8 هفته تمرین تناوبی شدید و مصرف مکمل خرفه، تفاوت معنی داری وجود دارد (89/13=F و 001/0=P). نتایج آزمون تعقیبی توکی نشان داد که سطح سرمی CRP در گروه کنترل کبد چرب به طور معنی داری نسبت به سالم کنترل بالاتر بود (001/0=P). سطح این شاخص در گروه مکمل، تمرین و تمرین+ مکمل به طور معنی داری نسبت به گروه کنترل کبدچرب پایینتر بود (مقادیر P به ترتیب 027/0، 006/0 و 001/0). بین سطح سرمی CRP در گروه تمرین، مکمل و تمرین+ مکمل تفاوت معنی داری مشاهده نشد (05/0<P). نمودار 3 مقایسه سطح سرمی CRP گروههای تحقیق را متعاقب 8 هفته تمرین تناوبی شدید و مصرف مکمل خرفه ارائه میدهد.
سطوح سرمی TNF-α گروههای تحقیق. نتایج حاصل از آنالیز واریانس یک طرفه نشان داد که بین سطح سرمی TNF-α گروههای تحقیق پس از 8 هفته تمرین تناوبی شدید و مصرف مکمل خرفه، تفاوت معنی داری وجود دارد (265/9=F و 001/0=P). نتایج آزمون تعقیبی توکی نشان داد که سطح سرمی TNF-α در گروه کنترل کبد چرب به طور معنی داری نسبت به سالم کنترل بالاتر بود (001/0=P). سطح این شاخص در گروه مکمل، تمرین و تمرین+ مکمل به طور معنی داری نسبت به گروه کنترل کبدچرب پایینتر بود (مقادیر p به ترتیب 005/0، 016/0 و 001/0). بین سطح سرمی TNF-α در گروه تمرین، مکمل و تمرین+ مکمل تفاوت معنی داری مشاهده نشد (05/0<P). نمودار 4 مقایسه سطح سرمی TNF-α گروههای تحقیق را متعاقب 8 هفته تمرین تناوبی شدید و مصرف مکمل خرفه ارائه میدهد.
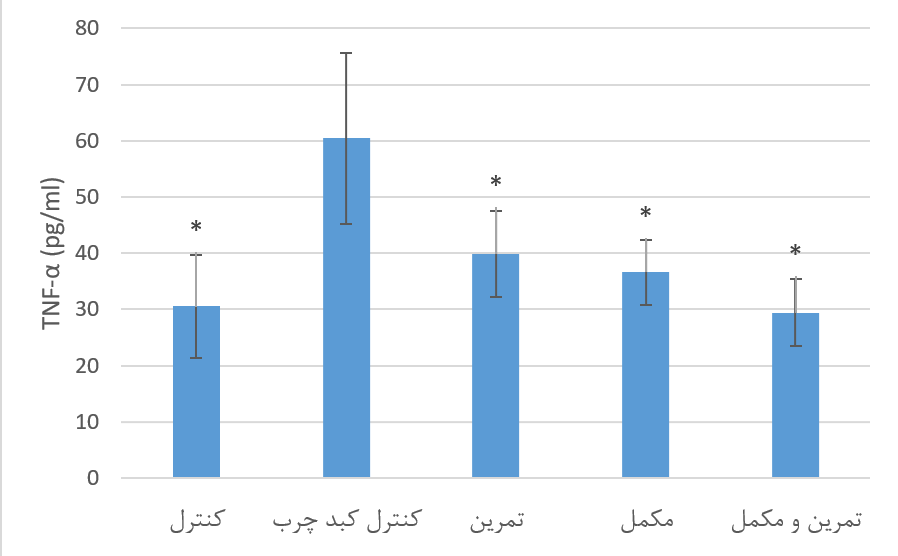
نمودار 4. مقایسه سطح سرمی TNF-α متعاقب 8 هفته تمرین تمرین تناوبی شدید و مصرف مکمل خرفه در گروههای تحقیق. * نشانه تفاوت معنادار نسبت به گروه کبد چرب کنترل در سطح معناداری 05/0P<.
بحث
بیماری کبد چرب غیر الکلی (NAFLD) به یک خطر مهم برای سلامتی تبدیل شده است و یکی از شایعترین علل بیماری مزمن کبد است. مطالعات اپیدمیولوژیک مختلف شیوع NAFLD را در محدوده 18 درصد تا 46 درصد در جمعیت عمومی تخمین زدهاند (34). این بیماری در ابتدا به عنوان یک بیماری خوش خیم در نظر گرفته میشد، اما اکنون به یکی از علل اصلی بیماری مزمن کبد تبدیل شده است و یافتن راههای کنترل و درمان این بیماری یکی از داغترین مباحث مجامع پزشکی به حساب میآید (15). کاظمی با بررسی تأثیر مکمل خرفه و تمرین تناوبی شدید بر کنترل گلیسمیک و دیس لیپیدمی در دانشجویان دختر چاق بیان کردند که مصرف همزمان مکمل خرفه و تمرین تناوبی شدید میتواند تأثیر بیشتری بر بهبود کنترل گلیسمیک و کاهش دیس لیپیدمی در دانشجویان دختر چاق نسبت به مصرف مکمل و تمرین تناوبی شدید به تنهایی داشته باشد (35). بنابراین هدف از تحقیق حاضر بررسی تأثیر تمرینات تناوبی با شدت بالا و مصرف همزمان مکمل خرفه میتواند بر سطوح MDA، TAC، CRP و TNF-α رت های نر مبتلا شده به NAFLD با رژیم غذایی پرچرب بود. نتایج تحقیق حاضر نشان داد که القای NAFLD در موشهای نر ویستار افزایش سطح عوامل التهابی CRP و TNF-α و افزایش عامل استرس اکسایشی MDA و کاهش TAC را در پی داشت. یکی از یافتههای تحقیق حاضر نشان داد که تمرین ورزشی تمرین تناوبی شدید کاهش سطح CRP، TNF-α و عدم تأثیر این تمرینات بر MDA و TAC در موشهای NAFLD را در پی داشت. همچنین نتایج تحقیق حاضر نشان داد که مصرف مکمل خرفه به تنهایی و همراه با تمرین ورزشی میتواند بهبود شاخصهای التهابی، استرس اکسایشی و آنتی اکسیدانی را در موشهای مبتلا به NAFLD به همراه داشته باشد.
فکوری جویباری و همکاران تأثیر هشت هفته تمرین هوازی به همراه مصرف مکمل خرفه بر شاخصهای پراکسیدانی و آنتی اکسیدانی در زنان مبتلا به دیابت نوع 2 را بررسی کردند. نتایج آنها نشان داد که تمرینات هوازی به همراه مصرف مکمل خرفه میتواند باعث بهبود تعادل پراکسیدانی (MDA) و آنتی اکسیدانی (SOD و CAT) در افراد مبتلا به دیابت نوع 2 شود (36). علی نیا و همکاران نیز اثر تمرین ترکیبی و مکمل گیری مکمل گیاه خرفه بر آنزیمهای کبدی در زنان یائسه چاق مبتلا به NAFLD را مورد بررسی قرار دادند. آنها بیان داشتند که مصرف مکمل گیاه خرفه همراه با تمرین ترکیبی میتواند سطح سرمی آنزیمهای کبدی را در زنان چاق مبتلا به NAFLD کاهش دهد و برای درمان این بیماری استفاده شود (37). صوفی و همکاران با بررسی تأثیر تمرین ورزشی منظم طولانی مدت به مدت یک سال بر اجزای گلوتاتیون در موشها به این نتیجه رسیدند که تمرین هوازی کوتاه مدت یک و دو ماهه تأثیری بر سطح GPx و MDA موشها ندارد ولی با افزایش طول دوره تمرین تأثیر تمرین بارزتر شده و تغییرات سطح شاخصها معنادار شده است (38). همراستا با نتایج تحقیق حاضر خالق زاده و همکاران نشان دادند که هشت هفته تمرین تناوبی شدید منجر به کاهش معنادار IL-6، TNF-α و آسپارتات آمینوترانسفراز در موشهای چاق مبتلا به NAFLD شد (39). همچنین کاوانیشی و همکاران گزارش دادند که ورزش مزمن (16 هفته) بیان TNF-α mRNA کبدی را در موشهایی که با رژیم غذایی پرچرب تغذیه میشوند، کاهش میدهد (40). در تحقیق دیگری، آنها دریافتند که تمرین مزمن، التهاب کبدی را که توسط TNF-α مورد بررسی قرار گرفت را کاهش میدهد و همچنین کموکاین ها و مولکولهای چسبندگی را در مدل موش NASH ناشی از رژیم غذایی پرچرب سرکوب میکند، نفوذ ماکروفاژهای التهابی کبدی را کاهش میدهد و کبد چرب را ضعیف میکند (41). افزایش وزن و درصد چربی متعاقب آن در بیماران مبتلا به NAFLD به عنوان یکی از مهمترین دلایل ایجاد التهاب و شروع کننده بیماری عنوان شده است، از این منظر کاهش وزن در این بیماران میتواند بسیار مفید باشد. صومی و همکاران با بررسی یک دوره برنامه مداخله کاهش وزن در آزمودنیهای مبتلا به NAFLD، کاهش معنادار عوامل التهابی از جمله مقادیر CRP را نشان داد (42).
همانطور که عنوان شد یکی از عوامل اصلی سبب شناسی NAFLD استرس اکسایشی و آسیبهای اکسایشی متعاقب آن میباشد که منجر به التهاب و پیشرفت بیماری میشوند (43). گزارش شده است که پیشرفت بیماری NAFLD با کاهش بیشتر TAC کبد همراه است (5). در این راستا در تحقیق مشابهی تنظیم کاهشی ژنهای کد کننده آنزیمهای آنتی اکسیدان در مبتلایان به سیروز کبدی ناشی از NAFLD گزارش شده است (44). همچنین یسیلوا و همکاران نیز در تحقیق خود افزایش سطح سرمی MDA و کاهش آنزیمهای آنتی اکسیدانی را در مردان مبتلا به NAFLD گزارش کردند (45). از طرف دیگر سطوح بالاتری از TNF-α را در کبد موشهای مبتلا به NAFLD گزارش شده است، در حالی که IL-10 به عنوان یک سایتوکاین ضد التهابی به طور قابلتوجهی کاهش مییابد (46). همچنین التهاب سیستمیک درجه پایین با افزایش سطوح نشانگرهای التهابی مختلف از جمله CRP همراه است (14). گزارش شده است که در شرایط بیماری NAFLD، افزایش تولید گونههای فعال اکسیژن میتوکندریایی و کاهش دفاع آنتی اکسیدانی میتواند شرایط استرس اکسایشی را افزایش داده و منجر به پراکسیداسیون لیپیدی، اکسیداسیون پروتئینها و اکسیداسیون DNA گردد و آسیب میتوکندریایی را باعث شود (46, 47). افزایش استرس اکسایشی با تغییر پتانسیل غشای میتوکندری و همچنین از دست دادن یکپارچگی میتوکندری در NAFLD مرتبط است (48). به عنوان مثال، کاردیولیپین، یک فسفولیپید منحصر به فرد موجود در غشای میتوکندری داخلی، به استرس اکسایشی بسیار حساس است و در نتیجه باعث باز شدن منافذ انتقال نفوذپذیری میتوکندری (MPT) میشود، که پیشنهاد شده است مسیرهایی را برای آزادسازی سیتوزولی الگوهای مولکولی مرتبط با خطر میتوکندریایی (mtDAMPs) برای تحریک سیگنالهای پیش التهابی فعال میکند (49, 50). برای نمونه عنوان شده است که mtDNA که از میتوکندری سلولهای کبدی جدا شده است، میتواند سیگنالهای ایمنی ذاتی را فعال کند (51). در موشهای تغذیه با رژیم غذایی پرچرب، پس از آزاد شدن mtDNA در اثر استرس اکسایشی (همانطور که در بیماری زایی NASH رخ میدهد) برای تحریک سیگنالهای ذاتی و فیبروژنز تعامل دارد و پیشرفت بیماری را تحریک میکند (52). آزادسازی خارج سلولی پروتئین مرتبط با mtDNA، فاکتور رونویسی میتوکندری A (TFAM)، همچنین میتواند به عنوان mtDAMP برای تحریک فعالیت ماکروفاژهای پیش التهابی عمل کند (53). mtdsRNA اخیراً به عنوان یک mtDAMP جدید شناخته شده است که با حسگر dsRNA برای تحریک سیگنالهای ایمنی ذاتی تعامل دارد. در یک مدل بیماری کبدی الکلی، سلولهای کبدی mtdsRNA اگزوزومی تولید میکنند تا فعالسازی TLR3 و متعاقب آن بیان IL-1 در KC را میانجی گری کنند (54). علاوه بر این نشان داده شده است که mtDNA در اثر رژیم غذایی پرچرب میتواند NF-κβ را فعال کند (55).
از طرف دیگر استفاده از گیاهان دارویی در درمان بیماریهای کبدی بسیار مورد تأکید قرار گرفته است. چندین فعالیت دارویی برای خرفه از جمله خواص آنتی اکسیدانی، ضد التهابی، ضد سرطانی، تعدیل کننده ایمنی و خواص ضد درد، گزارش شده است (56, 57). دو آلکالوئید جدا شده از گیاه خرفه، اولراکون و اولراسیمین، اثرات ضد التهابی قابل توجهی بر ماکروفاژهای تحریک شده با LPS نشان دادهاند. این ترکیبات به طور قابل ملاحظهای از تولید اکسید نیتریک (NO) جلوگیری میکنند. علاوه بر این، آنها به طور قابل توجهی ترشح IL-6، TNF-α، NO و پروستاگلاندین E2 و همچنین mRNA سیکلواکسیژناز 2 و نیتریک اکسید سنتاز القایی را کاهش دادند (58). همچنین چن و همکاران تأثیر عصاره آبی خرفه را بر استرس اکسایشی در موشهای چاق مورد بررسی قرار دادند. آنها دوزهای مختلف عصاره آبی خرفه را مورد استفاده قرار دادند. نتایج آنها نشان داد که تجویز عصاره آبی خرفه به صورت وابسته به دوز سطح پراکسیداسیون لیپیدی خون و کبد را کاهش داد که با افزایش فعالیت آنزیمهای آنتی اکسیدانی خون و کبد در موشهای چاق همراه بود (59). همچنین مطالعات در مورد گیاه خرفه نشان داده است که این گیاه به علت داشتن ترکیب گلوتاتیون، دارای خواص آنتی دیابتی، هیپولیپیدمیک و اثرات مثبت بر سیستم عصبی بوده که باعث تغییر فعالیت آنزیم گلوتاتیون ردوکتاز و کاهش معنادار در پراکسیداسیون لیپیدهای وابسته به فعالیت آنزیمهای سوپراکسید دیسموتاز و کاتالاز میشود (60, 61). شارما و همکاران نشان داد چنانچه در جیره غذایی، نسبت اسیدهای چرب غیراشباع به اسیدهای چرب اشباع کاهش یابد، میزان لپتین سرم، TNF-α و اینترلوکین ها افزایش مییابد (62). خرفه به علت فراوانی اسیدهای چرب غیر اشباع موجب کاهش معنادار در غلظت TNF-α و افزایش معنادار سطح mRNA لیپوپروتئین لیپاز در کبد میشود (63) و هیچ خاصیت سیتوتوکسیسیتی یا ژنوتوکسیسیتی ندارد (64). در نهایت میتوان چنین گفت که خرفه احتمالاً از طریق کاهش میزان لیپیدها و در پی آن کاهش TNF-α، به بهبود عملکرد کبد و کاهش سطح سرمی آنزیمهای کبدی کمک میکند (32). ترکیبات آنتی اکسیدانی شامل آلفا توکوفرول، اسید اسکوربیک و گلوتاتیون ها در خرفه به وفور یافت میشود. همچنین این گیاه منبع خوبی برای کوآنزیم Q10 بوده و کومارین و گلیکوزیدهای قلبی آنتراکینونی از دیگر ترکیبات آن میباشد (65) و بنابراین میتواند برای کنترل پیشرفت این بیماری مورد استفاده قرار گیرد. تحقیق حاضر با محدودیتهایی از قبیل کم بودن تعداد آزمودنیها روبرو بوده است. توصیه میشود در تحقیقات آتی با نمونههای آماری بیشتری تحقیقات مشابه صورت گیرد.
نتیجه گیری
در مجموع نتایج تحقیق حاضر نشان دهنده عدم تأثیر تمرین تناوبی شدید به تنهایی بر سطح MDA و TAC اما تأثیر مثبت بر سطح TNF-α و CRP موشهای مبتلا به NAFLD میباشد. اما ترکیب تمرین ورزشی و مکمل خرفه نتایج مطلوبی را در تمامی این شاخصها به همراه دارد. بنابراین به نظر میرسد تمرین تناوبی شدید طولانی مدت و مصرف مکمل خرفه از طریق کاهش پراکسیدان لیپیدی و بهبود عوامل آنتی اکسیدانی میتواند اثرات مثبتی در التهاب کبدی بیماران مبتلا به NAFLD در پی داشته باشد و بنابراین میتواند نقش مهمی را در کنترل پیشرفت این بیماری بر عهده داشته باشند.
تشکر و قدردانی
محققان بر خود واجب میدانند از تمامی کسانی که ما را در انجام این تحقیق یاری کردند کمال تشکر و قدردانی را به جای آورند.
همه مراحل پژوهش باتوجه به دستورالعمل کمیته اخلاق در پژوهشهای زیست پزشکی دانشگاه علوم پزشکی خراسان شمالی و با کد IR.NKUMS.REC.1400.075 انجام شد.
References
1. Sanyal AJ, Brunt EM, Kleiner DE, Kowdley KV, Chalasani N, Lavine JE, et al. Endpoints and clinical trial design for nonalcoholic steatohepatitis. Hepatology. 2011;54(1):344-353. doi: 10.1002/hep.24376 pmid: 21520200
2. Kleiner DE, Makhlouf HR. Histology of Nonalcoholic Fatty Liver Disease and Nonalcoholic Steatohepatitis in Adults and Children. Clin Liver Dis. 2016;20(2):293-312. doi: 10.1016/j.cld.2015.10.011 pmid: 27063270
3. Yasui K, Hashimoto E, Komorizono Y, Koike K, Arii S, Imai Y, et al. Characteristics of patients with nonalcoholic steatohepatitis who develop hepatocellular carcinoma. Clin Gastroenterol Hepatol. 2011;9(5):428-433; quiz e450. doi: 10.1016/j.cgh.2011.01.023 pmid: 21320639
4. Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114(4):842-845. doi: 10.1016/s0016-5085(98)70599-2 pmid: 9547102
5. Videla LA, Rodrigo R, Orellana M, Fernandez V, Tapia G, Quinones L, et al. Oxidative stress-related parameters in the liver of non-alcoholic fatty liver disease patients. Clin Sci (Lond). 2004;106(3):261-268. doi: 10.1042/CS20030285 pmid: 14556645
6. Browning JD, Horton JD. Molecular mediators of hepatic steatosis and liver injury. J Clinic Invest. 2004;114(2):147-152. doi: 10.1172/JCI200422422
7. Bell M, Wang H, Chen H, McLenithan JC, Gong DW, Yang RZ, et al. Consequences of lipid droplet coat protein downregulation in liver cells: abnormal lipid droplet metabolism and induction of insulin resistance. Diabetes. 2008;57(8):2037-2045. doi: 10.2337/db07-1383 pmid: 18487449
8. Cobbina E, Akhlaghi F. Non-alcoholic fatty liver disease (NAFLD) - pathogenesis, classification, and effect on drug metabolizing enzymes and transporters. Drug Metab Rev. 2017;49(2):197-211. doi: 10.1080/03602532.2017.1293683 pmid: 28303724
9. Orangi E, Ostad Rahimi A, Mahdavi R, Somi M, Tarzemani M. Oxidative stress-related parameters and antioxidant status in non-alcoholic fatty liver disease patients. Iran J Endocrinol Metabol. 2011;12(5):493-499.
10. Madan K, Bhardwaj P, Thareja S, Gupta SD, Saraya A. Oxidant stress and antioxidant status among patients with nonalcoholic fatty liver disease (NAFLD). J Clin Gastroenterol. 2006;40(10):930-935. doi: 10.1097/01.mcg.0000212608.59090.08 pmid: 17063114
11. Klisic A, Isakovic A, Kocic G, Kavaric N, Jovanovic M, Zvrko E, et al. Relationship between Oxidative Stress, Inflammation and Dyslipidemia with Fatty Liver Index in Patients with Type 2 Diabetes Mellitus. Exp Clin Endocrinol Diabetes. 2018;126(6):371-378. doi: 10.1055/s-0043-118667 pmid: 28895641
12. Anderson N, Borlak J. Molecular mechanisms and therapeutic targets in steatosis and steatohepatitis. Pharmacol Rev. 2008;60(3):311-357. doi: 10.1124/pr.108.00001 pmid: 18922966
13. Joshi-Barve S, Barve SS, Amancherla K, Gobejishvili L, Hill D, Cave M, et al. Palmitic acid induces production of proinflammatory cytokine interleukin-8 from hepatocytes. Hepatology. 2007;46(3):823-830. doi: 10.1002/hep.21752 pmid: 17680645
14. Chiang CH, Huang CC, Chan WL, Chen JW, Leu HB. The severity of non-alcoholic fatty liver disease correlates with high sensitivity C-reactive protein value and is independently associated with increased cardiovascular risk in healthy population. Clin Biochem. 2010;43(18):1399-1404. doi: 10.1016/j.clinbiochem.2010.09.003 pmid: 20846522
15. Kumar R, Porwal YC, Dev N, Kumar P, Chakravarthy S, Kumawat A. Association of high-sensitivity C-reactive protein (hs-CRP) with non-alcoholic fatty liver disease (NAFLD) in Asian Indians: A cross-sectional study. J Family Med Prim Care. 2020;9(1):390-394. doi: 10.4103/jfmpc.jfmpc_887_19 pmid: 32110624
16. Lee J, Yoon K, Ryu S, Chang Y, Kim HR. High-normal levels of hs-CRP predict the development of non-alcoholic fatty liver in healthy men. PLoS One. 2017;12(2):e0172666. doi: 10.1371/journal.pone.0172666 pmid: 28234943
17. Lazo M, Solga SF, Horska A, Bonekamp S, Diehl AM, Brancati FL, et al. Effect of a 12-month intensive lifestyle intervention on hepatic steatosis in adults with type 2 diabetes. Diabetes Care. 2010;33(10):2156-2163. doi: 10.2337/dc10-0856 pmid: 20664019
18. Sung KC, Ryu S, Lee JY, Kim JY, Wild SH, Byrne CD. Effect of exercise on the development of new fatty liver and the resolution of existing fatty liver. J Hepatol. 2016;65(4):791-797. doi: 10.1016/j.jhep.2016.05.026 pmid: 27255583
19. Gibala MJ, Little JP, Macdonald MJ, Hawley JA. Physiological adaptations to low-volume, high-intensity interval training in health and disease. J Physiol. 2012;590(5):1077-1084. doi: 10.1113/jphysiol.2011.224725 pmid: 22289907
20. Hottenrott K, Ludyga S, Schulze S. Effects of high intensity training and continuous endurance training on aerobic capacity and body composition in recreationally active runners. J Sport Sci Med. 2012;11(3):483.
21. Francois ME, Little JP. Effectiveness and safety of high-intensity interval training in patients with type 2 diabetes. Diabetes Spectr. 2015;28(1):39-44. doi: 10.2337/diaspect.28.1.39 pmid: 25717277
22. Bacchi E, Negri C, Targher G, Faccioli N, Lanza M, Zoppini G, et al. Both resistance training and aerobic training reduce hepatic fat content in type 2 diabetic subjects with nonalcoholic fatty liver disease (the RAED2 Randomized Trial). Hepatology. 2013;58(4):1287-1295. doi: 10.1002/hep.26393 pmid: 23504926
23. Keating SE, Hackett DA, Parker HM, O'Connor HT, Gerofi JA, Sainsbury A, et al. Effect of aerobic exercise training dose on liver fat and visceral adiposity. J Hepatol. 2015;63(1):174-182. doi: 10.1016/j.jhep.2015.02.022 pmid: 25863524
24. Zhou YX, Xin HL, Rahman K, Wang SJ, Peng C, Zhang H. Portulaca oleracea L.: a review of phytochemistry and pharmacological effects. Biomed Res Int. 2015;2015:925631. doi: 10.1155/2015/925631 pmid: 25692148
25. Zidan Y, Bouderbala S, Djellouli F, Lacaille-Dubois MA, Bouchenak M. Portulaca oleracea reduces triglyceridemia, cholesterolemia, and improves lecithin: cholesterol acyltransferase activity in rats fed enriched-cholesterol diet. Phytomedicine. 2014;21(12):1504-1508. doi: 10.1016/j.phymed.2014.07.010 pmid: 25442258
26. Darvish Damavandi R, Shidfar F, Najafi M, Janani L, Masoodi M, Akbari-Fakhrabadi M, et al. Effect of Portulaca Oleracea (purslane) extract on liver enzymes, lipid profile, and glycemic status in nonalcoholic fatty liver disease: A randomized, double-blind clinical trial. Phytother Res. 2021;35(6):3145-3156. doi: 10.1002/ptr.6972 pmid: 33880813
27. Gheflati A, Adelnia E, Nadjarzadeh A. The clinical effects of purslane (Portulaca oleracea) seeds on metabolic profiles in patients with nonalcoholic fatty liver disease: A randomized controlled clinical trial. Phytother Res. 2019;33(5):1501-1509. doi: 10.1002/ptr.6342 pmid: 30895694
28. Ikhajiangbe H, Ezejindu D, Akingboye A. Hepatoprotective effects of Portulaca oleracea on liver enzymes of potassium bromate induced hepatotoxicity in adult wistar rats. Int J Med Sci. 2014;1:26-31.
29. Rahimlou M, Ahmadnia H, Hekmatdoost A. Dietary supplements and pediatric non-alcoholic fatty liver disease: Present and the future. World J Hepatol. 2015;7(25):2597-2602. doi: 10.4254/wjh.v7.i25.2597 pmid: 26557952
30. Aliniya N, Elmieh A, Fadaei Chafy M. The Effect of Combined Training and Portulaca Oleracea Supplementation on Plasma Lipid Profile and Liver Ultrasound in Obese Females With Nonalcoholic Fatty Liver Disease. J Arak Univ Med Sci. 2020;23(1):92-107. doi: 10.32598/JAMS.23.1.5910.2
31. Dehbashi M, Fathie M, Attarzadeh HSR, Mosaferi ZM. The Effect Of Eight Weeks Of Endurance Training And Injection Of Growth Hormone Lipolytic Fragment (Aod9604) On Ck18 And Liver Enzymes Of Nafld-Induced Mice Induced By High-Fat Diet.2021.
32. Zarei A, Changizi Ashtiyani S, Taheri S. The effects of hydroalcoholic extract of Portulaca Oleracea on the serum concentreation of Hepatic enzymes in Rats. ISMJ. 2014;17(5):889-899. doi: 10.17795/zjrms1007
33. Hafstad AD, Boardman NT, Lund J, Hagve M, Khalid AM, Wisloff U, et al. High intensity interval training alters substrate utilization and reduces oxygen consumption in the heart. J Appl Physiol (1985). 2011;111(5):1235-1241. doi: 10.1152/japplphysiol.00594.2011 pmid: 21836050
34. Williams CD, Stengel J, Asike MI, Torres DM, Shaw J, Contreras M, et al. Prevalence of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis among a largely middle-aged population utilizing ultrasound and liver biopsy: a prospective study. Gastroenterology. 2011;140(1):124-131. doi: 10.1053/j.gastro.2010.09.038 pmid: 20858492
35. Kazemi F. Effects of the Portulaca oleracea supplement and high-intensity interval training on glycemic control and dislipidemia in obese female students. Metabol Exercise. 2022;11(2).
36. Fakoory JM, Farzanegi P, Barari A. The effect of 8-week aerobic exercise with purslane supplementation consumption on peroxidant and antioxidants indicators in women with type 2 diabetes.2014.
37. Aliniya N, Elmieh A, Fadaei Chafy MR. Interaction Effect of Combined Exercise and Supplementation With Portulaca Oleracea on Liver Enzymes in Obese Postmenopausal Women With Non-Alcoholic Fatty Liver Disease. Complement Med J. 2020;10(1):68-79. doi: 10.32598/cmja.10.1.960
38. Ghadiri Soufi F, Aslanabadi N, Ahmadiasl N. The Influence of Regular Exercise on the Glutathione Cycle Components: Antioxidant Defense Improvement Against Oxidative Stress. Horizon Med Sci. 2011;16(4).
39. Khaleghzadeh H, Afzalpour ME, Ahmadi MM, Nematy M, Sardar MA. Effect of high intensity interval training along with Oligopin supplementation on some inflammatory indices and liver enzymes in obese male Wistar rats with non-alcoholic fatty liver disease. Obesit Med. 2020;17:100177. doi: 10.1016/j.obmed.2019.100177
40. Kawanishi N, Yano H, Yokogawa Y, Suzuki K. Exercise training inhibits inflammation in adipose tissue via both suppression of macrophage infiltration and acceleration of phenotypic switching from M1 to M2 macrophages in high-fat-diet-induced obese mice. Exercise immunology review.2010. 16 p.
41. Somi MH, Boostani K, Azadbakht S, Alizadeh M, Eftekharsadat AT, Ghojazadeh M. Determine effect of weight loss on serum level of inflammatory cytokines IL-1β, IL-6, CRP andTNF-α in obese patients with fatty liver disease. Med J Tabriz Univ Med Sci. 2017;39(3):61-69.
42. Ucar F, Sezer S, Erdogan S, Akyol S, Armutcu F, Akyol O. The relationship between oxidative stress and nonalcoholic fatty liver disease: Its effects on the development of nonalcoholic steatohepatitis. Redox Rep. 2013;18(4):127-133. doi: 10.1179/1351000213Y.0000000050 pmid: 23743495
43. Sreekumar R, Rosado B, Rasmussen D, Charlton M. Hepatic gene expression in histologically progressive nonalcoholic steatohepatitis. Hepatology. 2003;38(1):244-251. doi: 10.1053/jhep.2003.50290 pmid: 12830008
44. Yesilova Z, Yaman H, Oktenli C, Ozcan A, Uygun A, Cakir E. Systemic markers of lipid peroxidation and antioxidants in patients with nonalcoholic fatty liver disease. Official J American College Gastroenterol ACG. 2005;100(4):850-855. doi: 10.1111/j.1572-0241.2005.41500.x
45. Hajighasem A, Farzanegi P, Mazaheri Z. Effects of combined therapy with resveratrol, continuous and interval exercises on apoptosis, oxidative stress, and inflammatory biomarkers in the liver of old rats with non-alcoholic fatty liver disease. Arch Physiol Biochem. 2019;125(2):142-149. doi: 10.1080/13813455.2018.1441872 pmid: 29463133
46. Yin X, Zheng F, Pan Q, Zhang S, Yu D, Xu Z, et al. Glucose fluctuation increased hepatocyte apoptosis under lipotoxicity and the involvement of mitochondrial permeability transition opening. J Mol Endocrinol. 2015;55(3):169-181. doi: 10.1530/JME-15-0101 pmid: 26464382
47. Mantena SK, Vaughn DP, Andringa KK, Eccleston HB, King AL, Abrams GA, et al. High fat diet induces dysregulation of hepatic oxygen gradients and mitochondrial function in vivo. Biochem J. 2009;417(1):183-193. doi: 10.1042/BJ20080868 pmid: 18752470
48. Lin HY, Yang YL, Wang PW, Wang FS, Huang YH. The Emerging Role of MicroRNAs in NAFLD: Highlight of MicroRNA-29a in Modulating Oxidative Stress, Inflammation, and Beyond. Cells. 2020;9(4). doi: 10.3390/cells9041041 pmid: 32331364
49. Vringer E, Tait SWG. Mitochondria and Inflammation: Cell Death Heats Up. Front Cell Dev Biol. 2019;7:100. doi: 10.3389/fcell.2019.00100 pmid: 31316979
50. Zhong Z, Liang S, Sanchez-Lopez E, He F, Shalapour S, Lin XJ, et al. New mitochondrial DNA synthesis enables NLRP3 inflammasome activation. Nature. 2018;560(7717):198-203. doi: 10.1038/s41586-018-0372-z pmid: 30046112
51. Marques PE, Oliveira AG, Pereira RV, David BA, Gomides LF, Saraiva AM, et al. Hepatic DNA deposition drives drug-induced liver injury and inflammation in mice. Hepatology. 2015;61(1):348-360. doi: 10.1002/hep.27216 pmid: 24824608
52. Garcia-Martinez I, Santoro N, Chen Y, Hoque R, Ouyang X, Caprio S, et al. Hepatocyte mitochondrial DNA drives nonalcoholic steatohepatitis by activation of TLR9. J Clin Invest. 2016;126(3):859-864. doi: 10.1172/JCI83885 pmid: 26808498
53. Chaung WW, Wu R, Ji Y, Dong W, Wang P. Mitochondrial transcription factor A is a proinflammatory mediator in hemorrhagic shock. Int J Molecular Med. 2012;30(1):199-203. doi: 10.3892/ijmm.2012.959
54. Lee JH, Shim YR, Seo W, Kim MH, Choi WM, Kim HH, et al. Mitochondrial Double-Stranded RNA in Exosome Promotes Interleukin-17 Production Through Toll-Like Receptor 3 in Alcohol-associated Liver Injury. Hepatology. 2020;72(2):609-625. doi: 10.1002/hep.31041 pmid: 31849082
55. Lee J, Park JS, Roh YS. Molecular insights into the role of mitochondria in non-alcoholic fatty liver disease. Arch Pharm Res. 2019;42(11):935-946. doi: 10.1007/s12272-019-01178-1 pmid: 31571145
56. Baradaran Rahimi V, Rakhshandeh H, Raucci F, Buono B, Shirazinia R, Samzadeh Kermani A, et al. Anti-Inflammatory and Anti-Oxidant Activity of Portulaca oleracea Extract on LPS-Induced Rat Lung Injury. Molecules. 2019;24(1). doi: 10.3390/molecules24010139 pmid: 30609661
57. Rakhshandeh H, Rajabi Khasevan H, Saviano A, Mahdinezhad MR, Baradaran Rahimi V, Ehtiati S, et al. Protective Effect of Portulaca oleracea on Streptozotocin-Induced Type I Diabetes-Associated Reproductive System Dysfunction and Inflammation. Molecules. 2022;27(18). doi: 10.3390/molecules27186075 pmid: 36144807
58. Xu L, Ying Z, Wei W, Hao D, Wang H, Zhang W, et al. A novel alkaloid from Portulaca oleracea L. Nat Prod Res. 2017;31(8):902-908. doi: 10.1080/14786419.2016.1253081 pmid: 27806650
59. Chen B, Zhou H, Zhao W, Zhou W, Yuan Q, Yang G. Effects of aqueous extract of Portulaca oleracea L. on oxidative stress and liver, spleen leptin, PARalpha and FAS mRNA expression in high-fat diet induced mice. Mol Biol Rep. 2012;39(8):7981-7988. doi: 10.1007/s11033-012-1644-6 pmid: 22576880
60. Omidi H, Omidi H, Naghdibadi H. The Effect of Pistacia atlantica nut powder on liver phosphatidate phosphohydrolase and serum lipid profile in rat.2008.
61. Sultana A, Rahman K. Portulaca oleracea Linn. A global Panacea with ethno-medicinal and pharmacological potential. Int J Pharm Pharm Sci. 2013;5:33-39.
62. Sharma A, Vijayakumar M, Rao CV, Unnikrishnan M, Reddy G. Action of Portulaca oleracea against streptozotocin-induced oxidative stress in experimental diabetic rats. J Complement Integrative Med. 2009;6(1). doi: 10.2202/1553-3840.1181
63. Xio F, Lu F, Xu J. Mechanism of different parts of Portulaca oleracea in ameliorating lipid metabolic disorder in type 2 diabetic rats. Chine J Clin Rehabil. 2004;8(24):5042-5044.
64. El-Sayed MI. Effects of Portulaca oleracea L. seeds in treatment of type-2 diabetes mellitus patients as adjunctive and alternative therapy. J Ethnopharmacol. 2011;137(1):643-651. doi: 10.1016/j.jep.2011.06.020 pmid: 21718775
65. Okafor IA, Ayalokunrin MB, Orachu LA. A review on Portulaca oleracea (Purslane) plant-Its nature and biomedical benefits. Int J Biomed Res. 2014;5(2):75-80. doi: 10.7439/ijbr.v5i2.462
نوع مطالعه:
پژوهشي |
موضوع مقاله:
فیزیولوژی




